题目内容
将一支盛有a mL NO 和b mL NO2气体的试管倒立于水槽中,然后通过a mL O2,请回答以下小题:
(1)若a=b,则充分反应后试管内气体体积为_________mL。
(2)若a<b,则充分反应后试管内气体体积为_________mL。
(3)若a>b,则充分反应后试管内气体体积为_________mL。
(1)若a=b,则充分反应后试管内气体体积为_________mL。
(2)若a<b,则充分反应后试管内气体体积为_________mL。
(3)若a>b,则充分反应后试管内气体体积为_________mL。
(1)0 (2)(b-a)/3 (3)(a-b)/4
试题分析:NO 和 NO2气体与氧气、水反应涉及到的化学方程式为4NO+3O2+2H2O=4HNO3、4NO2+O2+2H2O=4HNO3、3NO2+H2O=2HNO3+NO
(1)a=b时,NO 和 NO2气体与氧气恰好完全反应,无气体剩余,体积为0;
(2)a<b时,氧气不足,aml的NO需要3a/4ml的氧气,a/4ml的氧气只能与aml的NO2反应,余(b-a)ml的NO2再与水反应产生(b-a)/3ml的NO;
 (3)a>b时,氧气过量,aml的NO需要3a/4ml的氧气,bml的NO2气体需要b/4ml的氧气,剩余氧气a-3a/4-b/4=(a-b)/4ml。2混合气体与氧气、水反应的计算
(3)a>b时,氧气过量,aml的NO需要3a/4ml的氧气,bml的NO2气体需要b/4ml的氧气,剩余氧气a-3a/4-b/4=(a-b)/4ml。2混合气体与氧气、水反应的计算
练习册系列答案
相关题目
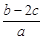
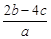
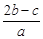
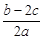
 mol
mol ×NA个该原子
×NA个该原子