题目内容
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为 。若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为 。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为 ,混合气体的平均相对分子质量为 。
(2)相同条件下,某Cl2与O2混合气体100 mL恰好与150 mL H2化合生成HCl和H2O,则混合气体中Cl2与O2的体积比为 ,混合气体的平均相对分子质量为 。
(1)27.6%;48.3% (2)1:1;51.5
(1)三种气体的平均相对分子质量为14.5×2=29,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设O2的物质的量分数为x,则CO和N2的物质的量分数为(1-x),因此有:32x+28(1-x)=29,解得x=0.25。O2的质量分数为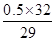 ×100%≈27.6%。若CO和N2的物质的量之比为1:1,设混合气体为1 mol,则混合气体中氧元素的物质的量为:0.25 mol×2+(0.75 mol÷2)×1=0.875 mol,氧元素的质量分数为
×100%≈27.6%。若CO和N2的物质的量之比为1:1,设混合气体为1 mol,则混合气体中氧元素的物质的量为:0.25 mol×2+(0.75 mol÷2)×1=0.875 mol,氧元素的质量分数为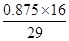 ×100%≈48.3%。(2)设Cl2的体积为x mL,则O2的体积为(100-x) mL。根据反应H2+Cl2
×100%≈48.3%。(2)设Cl2的体积为x mL,则O2的体积为(100-x) mL。根据反应H2+Cl2 2HCl、2H2+O2
2HCl、2H2+O2 2H2O知,反应中消耗的H2为:x mL+2(100-x) mL=150 mL,解得x=50 mL。因此n(Cl2):n(O2)=1:1。体积百分含量各占50%。混合气体的平均相对分子质量为:71×50%+32×50%=51.5。
2H2O知,反应中消耗的H2为:x mL+2(100-x) mL=150 mL,解得x=50 mL。因此n(Cl2):n(O2)=1:1。体积百分含量各占50%。混合气体的平均相对分子质量为:71×50%+32×50%=51.5。
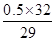 ×100%≈27.6%。若CO和N2的物质的量之比为1:1,设混合气体为1 mol,则混合气体中氧元素的物质的量为:0.25 mol×2+(0.75 mol÷2)×1=0.875 mol,氧元素的质量分数为
×100%≈27.6%。若CO和N2的物质的量之比为1:1,设混合气体为1 mol,则混合气体中氧元素的物质的量为:0.25 mol×2+(0.75 mol÷2)×1=0.875 mol,氧元素的质量分数为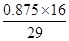 ×100%≈48.3%。(2)设Cl2的体积为x mL,则O2的体积为(100-x) mL。根据反应H2+Cl2
×100%≈48.3%。(2)设Cl2的体积为x mL,则O2的体积为(100-x) mL。根据反应H2+Cl2 2HCl、2H2+O2
2HCl、2H2+O2 2H2O知,反应中消耗的H2为:x mL+2(100-x) mL=150 mL,解得x=50 mL。因此n(Cl2):n(O2)=1:1。体积百分含量各占50%。混合气体的平均相对分子质量为:71×50%+32×50%=51.5。
2H2O知,反应中消耗的H2为:x mL+2(100-x) mL=150 mL,解得x=50 mL。因此n(Cl2):n(O2)=1:1。体积百分含量各占50%。混合气体的平均相对分子质量为:71×50%+32×50%=51.5。
练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目