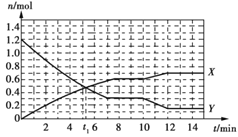
题目内容
【题目】某兴趣小组设计的简易原电池装置如下图所示。该电池工作时,下列说法不正确的是
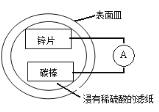
A.锌片作负极
B.碳棒上有气泡产生
C.电子由锌片经导线流向碳棒
D.可将电能转化为化学能
【答案】D
【解析】
Zn、碳和稀硫酸构成原电池中,锌为负极,发生失去电子的氧化反应,电极反应式为Zn﹣2e﹣═Zn2+,碳为正极,发生得到电子的还原反应,电极反应式为2H++2e﹣=H2↑,电池工作时,电子从负极锌沿导线流向正极碳,内电路中阳离子移向正极,阴离子移向负极,据此解答。
A.Zn、碳和稀硫酸构成原电池中,Zn能与稀硫酸反应,而碳不能,Zn发生失去电子的氧化反应,锌为负极,故A正确;
B.碳为正极,发生得到电子的还原反应,电极反应式为2H++2e﹣=H2↑,所以碳棒上有气泡产生,故B正确;
C.电池工作时,电子从负极锌沿导线流向正极碳,故C正确;
D.原电池是将化学能转化为电能的装置,故D错误;
故答案选D。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案【题目】将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
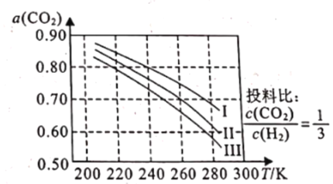
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________反应(填“放热”或“吸热")。设CO2的初始浓度为comolL-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________(填“上方”或“下方”)。
(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/k.Jmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
则:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2、Al(NO3)3混合液加入氨水调节pH=12(常温),然后将浊液高压恒温放置及煅烧等操作制备该催化剂。加入氨水调节pH=12时,c(Ni2+)为_______________。[已知:Ksp[Ni(OH)2]=5×10-16]