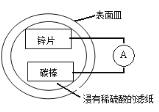
题目内容
【题目】将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道,其合成反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。回答下列问题:
CH3OH(g)+H2O(g)。回答下列问题:
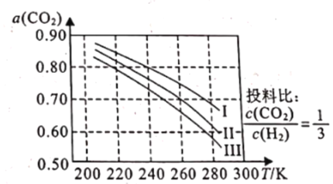
(1)如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa和5.0MPa。据图可知,该反应为_______________反应(填“放热”或“吸热")。设CO2的初始浓度为comolL-1,根据5.0MPa时的数据计算该反应的平衡常数K(240k)=_______________ (列出计算式即可)。若在4.0MPa时减小投料比,则CO2的平衡转化率曲线可能位于II线的_______________(填“上方”或“下方”)。
(2)利用二氧化碳制得的甲醇还可以制取甲胺,其反应原理为CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
CH3NH2(g)+H2O(g)△H。已知该反应中相关化学键的键能数据如下:
共价键 | C—O | H—O | N—H | C—N |
键能/k.Jmol-1 | 351 | 463 | 393 | 293 |
则该反应的△H=_______________k.Jmol-1 。
(3)已知:①CO(g)+NO2(g)![]() CO2(g)+NO(g) △H1=-226kJrnol-1
CO2(g)+NO(g) △H1=-226kJrnol-1
②N2(g)+2O2(g)![]() 2NO2(g)△H2=+68kJmol-1
2NO2(g)△H2=+68kJmol-1
③N2(g)+O2(g)![]() 2NO(g) △H3=+183kJmol-1
2NO(g) △H3=+183kJmol-1
则:2CO(g)+2NO(g)![]() 2CO2(g)+N2(g) △H=_______________kJmol-1。
2CO2(g)+N2(g) △H=_______________kJmol-1。
(4)一定温度下,下列措施一定能加快反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
CH3OH(g)+H2O(g)的速率的是_______________(填选项字母)。
A.及时移去甲醇 B.改进催化剂 C.提高反应物浓度 D.增大容器压强
(5)甲烷重整可选氧化物NiO- Al2O3作为催化剂,工业上常用Ni(NO3)2、Al(NO3)3混合液加入氨水调节pH=12(常温),然后将浊液高压恒温放置及煅烧等操作制备该催化剂。加入氨水调节pH=12时,c(Ni2+)为_______________。[已知:Ksp[Ni(OH)2]=5×10-16]
【答案】放热 ![]() 上方 -12 -750 BC 5×10-2 mol·L-1
上方 -12 -750 BC 5×10-2 mol·L-1
【解析】
(1)根据图像,随着温度的升高,CO2的转化率降低,说明升高温度平衡向逆反应方向移动,根据勒夏特列原理,推出该反应的正反应是放热反应:反应为气体体积减小的反应,作等温线,增大压强,平衡向正反应方向移动,CO2的转化率增大,I为5.0MPa下进行的曲线,240K时CO2的转化率为0.8,则可列三段式为
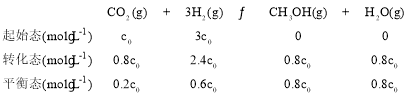
根据化学平衡常平数的表达式K= ![]() ;根据上述分析,II曲线代表4.0MPa下进行的曲线,减小投料比,相当于增大H2的量,CO2的量不变,平衡向正反应方向进行,CO2的转化率增大,即CO2的平衡转化曲线可能位于II曲线的上方,故答案为:放热;
;根据上述分析,II曲线代表4.0MPa下进行的曲线,减小投料比,相当于增大H2的量,CO2的量不变,平衡向正反应方向进行,CO2的转化率增大,即CO2的平衡转化曲线可能位于II曲线的上方,故答案为:放热;![]() ;上方;
;上方;
(2)反应热等于反应物总键能减去生成物总键能,故△H =351 kJ/mol +393 kJ/mol -293 kJ/mol -463kJ/mol=-12kJ/mol,故答案为:-12;
(3)由盖斯定律:①×2+②-③×2可得:2CO(g)+2NO(g) ![]() 2CO2(g)+N2(g)△H=-750kJmol-1,故答案为:-750;
2CO2(g)+N2(g)△H=-750kJmol-1,故答案为:-750;
(4)A.及时移去甲醇,则生成物的浓度减小,反应速率减慢,故A错误;
B.改进催化剂能加快反应速率,故B正确;
C.提高反应物浓度,反应物浓度增大,则反应速率加快,故C正确;
D.若缩小体积而使容器压强增大,则反应速率加快,若通入惰性气体使容器压强增大,则反应速率不变,故D错误;
综上所述,答案为:BC;
(5)pH=12,c(OH-)=0.01mol·L-1,Ksp[Ni(OH)2]=5×10-16,c(Ni2+)=![]() ,故答案为:5×10-2 mol·L-1。
,故答案为:5×10-2 mol·L-1。

【题目】下列有关实验操作、现象、解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 充分吸收了Na2SiO3 饱和溶液的小木条,沥干后放在酒精灯外焰加热 | 小木条不燃烧 | Na2SiO3 可作防火剂 |
B | 将 H2 在充满Cl2 的集气瓶中燃烧 | 集气瓶口上方有白烟生成 | H2、Cl2 化合生成HCl |
C | 将 SO2 通入酸性高锰酸钾溶液中 | 溶液褪色 | SO2 具有氧化性 |
D | 除去表面氧化膜的铝箔,在酒精灯上充分加热 | 铝不能滴落下来 | 铝熔点高,没能熔化 |
A.AB.BC.CD.D