题目内容
2.下列表示0.1mol/L NaHCO3溶液中有关微粒浓度(mol/L)的关系式中,正确的是( )| A. | c(Na+)>c(HCO${\;}_{3}^{-}$)>c(CO${\;}_{3}^{2-}$)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| C. | c(Na+)+c(H+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(OH-) | |
| D. | c(Na+)=c(HCO${\;}_{3}^{-}$)+2c(CO${\;}_{3}^{2-}$)+c(H2CO3) |
分析 NaHCO3溶液中溶液呈碱性,所以c (OH-)>c (H+),钠离子不水解,碳酸氢根离子水解,所以c(Na+)>c (HCO3-),盐中阴阳离子浓度大于水电离出氢氧根离子浓度,所以离子浓度大小顺序是c(Na+)>c (HCO3-)>c (OH-)>c (H+);溶液中还存在电荷守恒:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),物料守恒:c(Na+)=c (HCO3-)+c (CO32-)+c (H2CO3),据此进行判断.
解答 解:A.溶液呈碱性,所以c (OH-)>c (H+),钠离子不水解,碳酸氢根离子水解,所以c(Na+)>c (HCO3-),盐中阴阳离子浓度大于水电离出氢氧根离子浓度,所以离子浓度大小顺序是c(Na+)>c (HCO3-)>c (OH-)>c (H+),故A正确;
B.根据质子守恒得:c(Na+)+c(H+)=c(HCO3-)+2 c(CO32-)+c(OH-),故B错误;
C.根据电荷守可知:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故C正确;
D.根据物料守恒得c(Na+)=c (HCO3-)+c (CO32-)+c (H2CO3),故D错误;
故选AC.
点评 本题考查离子浓度的大小比较,题目难度中等,注意把握弱电解质的电离和盐类水解的原理,从守恒的角度比较离子浓度大小是常用的方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.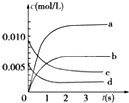 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)判断该反应是(是或不是)可逆反应,800℃,反应达到平衡时,v(NO)化学反应速率是0.0022mol/(L•s);v(O2)化学反应速率0.0011mol/(L•s).
(2)如图中表示NO2的变化的曲线是b.
(3)能说明该反应已达到平衡状态的是bcd.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内温度保持不变.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.
(3)能说明该反应已达到平衡状态的是bcd.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内温度保持不变.
7.胶体区别于其它分散系最本质的特征是( )
| A. | 外观澄清、透明 | B. | 胶体粒子直径在1~100nm之间 | ||
| C. | 能产生丁达尔现象 | D. | 外观澄清、不透明 |
14.下列关于氯气的叙述中不正确的是( )
| A. | 可用向上排空气法收集少量的氯气 | |
| B. | 与水反应生成的次氯酸是一种弱酸 | |
| C. | 与石灰乳反应时,Cl2既被还原,同时又被氧化 | |
| D. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2与铁不能发生化学反应 |
11.下列有关氮元素及其化合物的表示正确的是( )
| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 氮离子(N3-)的结构示意图: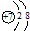 | |
| C. | 氨分子的电子式: | |
| D. | 硝基苯的结构简式: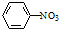 |
12.下列说法不正确的是( )
| A. | 氯气是既不是电解质,也不是非电解质,但其水溶液却可以导电 | |
| B. | Al2O3和MgO都是属于离子化合物,熔沸点都很高,故工业上常用熔点较低的AlCl3和MgCl2来冶炼金属 | |
| C. | H2O是分子晶体,晶体中含氢键,其熔沸点一般比同主族的氢化物要高 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
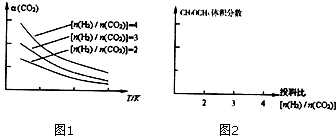 将燃煤废气中的CO2转化为二甲醚的反应原理为:
将燃煤废气中的CO2转化为二甲醚的反应原理为: