题目内容
7.实验室很多化学药品长期放置会变质,氢氧化钠放置一段时间后,有一部分变成碳酸钠.取部分已变质的氢氧化钠固体样品6.12g,溶于水得到100mL溶液,向其中加入足量的氯化钡溶液,生成白色沉淀.过滤,将沉淀洗净、烘干,称量质量为3.94g.(1)写出上述溶液中所发生反应的离子方程式
(2)样品溶于水所得溶液中氢氧化钠的物质的量浓度.
分析 (1)碳酸钠与氯化钡反应生成碳酸钡沉淀与NaCl;
(2)生成3.94g沉淀为碳酸钡,由碳酸根守恒可知n(Na2CO3)=n(BaCO3),再结合样品质量计算样品中NaOH物质的量,根据c=$\frac{n}{V}$计算氢氧化钠的物质的量浓度.
解答 解:(1)碳酸钠与氯化钡反应生成碳酸钡沉淀与NaCl,反应离子方程式为:Ba2++CO32-=BaCO3↓,
答:反应离子方程式为Ba2++CO32-=BaCO3↓.
(2)生成3.94g沉淀为碳酸钡,由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=$\frac{3.94g}{197g/mol}$=0.02mol,样品质量计算样品中NaOH物质的量为$\frac{6.12g-0.02mol×106g/mol}{40g/mol}$=0.1mol,故氢氧化钠的物质的量浓度为$\frac{0.1mol}{0.1L}$=1mol/L,
答:溶于水所得溶液中氢氧化钠的物质的量浓度为1mol/L.
点评 本题考查化学方程式计算、离子方程式书写,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列反应中需加入还原剂才能进行的是( )
| A. | Cl2→ClO- | B. | Zn→Zn2+ | C. | H+→H2 | D. | CuO→CuCl2 |
15.下列实验中所选用的仪器合理的是( )
| A. | 用100mL量筒量取5.2mL稀硫酸 | |
| B. | 用碱式滴定管量取20.10mLCCl4 | |
| C. | 用托盘天平称取8.56g食盐 | |
| D. | 用酸式滴定管量取20.50mLKMnO4溶液 |
2.下列有关胶体的叙述中不正确的是( )
| A. | 淀粉溶胶中混有的氯化钠可以利用渗析的方法除去 | |
| B. | 向氢氧化铁胶体中逐滴滴入硫酸溶液,可以观察到先出现红褐色沉淀而后沉淀溶解形成澄清溶液 | |
| C. | 胶体介稳的主要原因是胶体带有电荷 | |
| D. | 可以利用丁达尔效应来鉴别胶体和溶液 |
19.下列关于物质的结构和性质的说法正确的是( )
| A. | 因为NaCl溶液导电,所以NaCl晶体中含有离子键 | |
| B. | 因为N的最外层电子数为5,所以N2中有3个非极性共价键 | |
| C. | 因为NH4Cl全部由非金属元素组成,所以NH4Cl是共价化合物 | |
| D. | 因为Na2O2中的原子个数比是1:1,所以离子个数比也是1:1 |
16.下列叙述正确的是( )
| A. | 甲烷分子中4个氢原子可能在同一平面上 | |
| B. | 乙烯分子中共6个原子都在同一平面上 | |
| C. | 苯分子中碳原子和全部氢原子不可能在同一平面上 | |
| D. | 乙炔分子中4个原子不可能在同一条直线上 |
17.下列离子方程式正确的是( )
| A. | 铜与硝酸银溶液反应:Ag++Cu═Ag+Cu2+ | |
| B. | 石灰石与盐酸反应:CO${\;}_{3}^{2-}$+2H+═H2O+CO2↑ | |
| C. | 向澄清石灰水中通入少量CO2使溶液变浑浊:CO2+Ca2++2OH${\;}^{_}$═H2O+CaCO3↓ | |
| D. | 铁屑与盐酸反应:2Fe+6H+═2Fe3++3H2↑ |

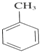 +3HNO3$\stackrel{浓硫酸}{→}$
+3HNO3$\stackrel{浓硫酸}{→}$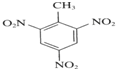 +3H2O.
+3H2O.