题目内容
下列各图所表示的反应是吸热反应的是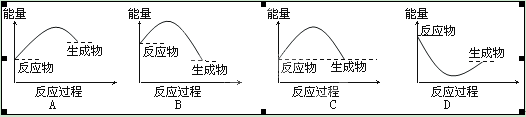
A
解析试题分析:A、根据图像可知,反应物的总能量低于生成物的总能量,因此该反应是吸热反应,A正确;B、根据图像可知,反应物的总能量高于生成物的总能量,因此该反应是放热反应,B不正确;C、根据图像可知,反应物的总能量等于生成物的总能量,因此不符合客观事实,C不正确;D、根据图像可知,反应物的总能量高于生成物的总能量,因此该反应是放热反应,且该反应过程不符合客观事实,D不正确,答案选A。
考点:考查放热反应和吸热反应的判断

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
下列关于化学反应与能量的说法正确的是
| A.铵盐与碱的反应一般为放热反应 |
| B.化学反应一定既伴随着物质变化又伴随着能量变化 |
| C.反应物断旧键所吸收的能量高于生成物形成新键所放出的能量的反应为放热反应 |
| D.反应物所具有的总能量高于生成物所具有的总能量的反应为吸热反应 |
下列说法正确的是
| A.CO能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 |
| B.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| C.相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量 |
| D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 |
某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。对该反应的有关叙述正确的是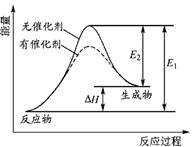
| A.该反应的正反应为吸热反应 |
| B.催化剂能改变反应的焓变 |
| C.催化剂不能降低反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
已知N2(g)+3H2(g) 2NH3(g) △H=— 92.4kJ?mo1—1,下列结论正确的是
2NH3(g) △H=— 92.4kJ?mo1—1,下列结论正确的是
| A.在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ |
B.N2(g)+3H2(g) 2NH3(l)△H=— QkJ?mo1—1,则Q>92.4 2NH3(l)△H=— QkJ?mo1—1,则Q>92.4 |
| C.增大压强,平衡向右移动,平衡常数增大 |
| D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60% |
已知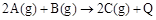 。下列说法或表达正确的是
。下列说法或表达正确的是
| A.使用催化剂可改变该反应的反应热 |
B.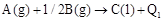 ; ;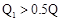 |
C.A和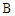 混合气体的稳定性比C气体强 混合气体的稳定性比C气体强 |
| D.该条件下,2LC气体分解成2LA气体与1LB气体吸收的热量为Q |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中加热△H ="-57.3" kJ/mol,则H2SO4和Ca(OH) 2反应的 中和热△H =2×(-57.3)kJ/mol |
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) 2CO(g)+O2(g)反应 2CO(g)+O2(g)反应的△H =" +2×283.0" kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应物的总键能与生成物的总键能之差。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
 Si(s)+4HCl(g),该反应的反应热△H为( )
Si(s)+4HCl(g),该反应的反应热△H为( )A.+412 kJ·mol-1 B.-412 kJ·mol-1
C.+236 kJ·mol-1 D.-236 kJ·mol-1
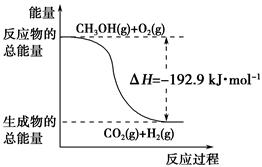
已知:①CH3OH (g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+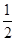 O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
下列说法正确的是 ( )。
| A.CH3OH转变成H2的过程一定要吸收能量 |
| B.①反应中,反应物的总能量高于生成物总能量 |
C.根据②推知反应:CH3OH(l)+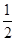 O2(g)===CO2(g)+2H2(g)的 O2(g)===CO2(g)+2H2(g)的ΔH>-192.9 kJ·mol-1 |
| D.反应②中的能量变化如下图所示 |