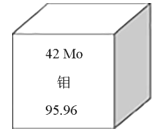
题目内容
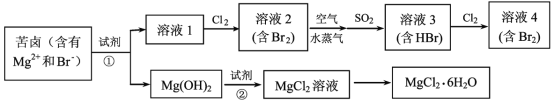
【题目】海水资源的利用具有广阔的前景。从海水中提取Br2与MgCl26H2O的流程如图:
(1)海水淡化的方法有蒸馏法、___(任写一种)等,考虑成本及效益试剂①可选用___。
(2)比较溶液中Br2的浓度:溶液2___溶液4(填“>”或“<”)。
(3)鼓入空气与水蒸气将Br2吹出,吹出的气体用SO2吸收,其化学方程式是__。
(4)从MgCl2溶液获得MgCl26H2O晶体的主要操作包括____。
【答案】电渗析法(或离子交换法) CaO或Ca(OH)2 < SO2+Br2+2H2O=2HBr+H2SO4 蒸发浓缩,降温结晶
【解析】
由流程图可知,向苦卤中加入碱,苦卤中镁离子与碱反应生成氢氧化镁沉淀,过滤;向溶液1中通入氯气,氯气与溶液中的溴离子发生置换反应生成含有浓度较低单质溴的溶液2,用空气和水蒸气吹出溴蒸气,溴蒸气与二氧化硫反应生成含有氢溴酸和硫酸的溶液3,再向所得溶液3通入氯气得到含溴浓度较高的溶液4,将氢氧化镁溶于盐酸中得到氯化镁溶液,氯化镁溶液蒸发浓缩,冷却结晶,过滤得到六水氯化镁。
(1)海水淡化的方法主要有蒸馏法、离子交换法、电渗析法等。向苦卤中加入碱,苦卤中镁离子与碱反应生成氢氧化镁沉淀,考虑成本及效益试剂①可以选用CaOH)2或生石灰,故本题答案为:电渗析法(或离子交换法);CaO或Ca(OH)2;
(2)由分析可知,溶液2含有单质溴浓度低于溶液4,故本题答案为:<;
(3)由分析可知,溶液中溴蒸气与二氧化硫反应生成含有氢溴酸和硫酸,反应的化学方程式为SO2+Br2+2H2O=2HBr+H2SO4,故本题答案为:SO2+Br2+2H2O=2HBr+H2SO4;
(4)从MgCl2溶液获得MgCl26H2O晶体的主要操作是蒸发浓缩,冷却结晶,过滤等操作,故本题答案为:蒸发浓缩,降温结晶。