题目内容
【题目】1.08g某有机物在过量纯氧中完全燃烧,可生成二氧化碳3.08g,水0.72g,同时消耗氧气2.72g。又知该有机物蒸气1.12L(已折算成标准状况下)的质量为5.4g。则
(1)求该有机物的分子式。__________________
(2)若该有机物跟FeCl3溶液作用显紫色,其一溴代物共有三种同分异构体,写出该有机物的结构简式。________________________
【答案】C7H80 ![]()
【解析】
(1)先计算出有机物的摩尔质量,再根据有机物燃烧计算出最简式,两者联立,即得分子式;
(2)该有机物跟FeCl3溶液作用显紫色,则含有酚羟基,其一溴代物共有三种同分异构体,则含有三种类型的等效氢原子。
(1)有机物蒸气1.12L即0.05mol(已折算成标准状况下)的质量为5.4g,所以有机物的摩尔质量=![]() =108g/mol,1.08g即0.01mol某有机物在过量纯氧中完全燃烧,可生成二氧化碳3.08g即0.07mol,水0.72g即0.04mol,同时消耗氧气2.72g即0.085mol,产物中的n(C)=0.07mol,n(H)=0.08mol,所以C个数是7,H个数是8,根据M=108,所以含有O的个数是1,即分子式为C7H80,
=108g/mol,1.08g即0.01mol某有机物在过量纯氧中完全燃烧,可生成二氧化碳3.08g即0.07mol,水0.72g即0.04mol,同时消耗氧气2.72g即0.085mol,产物中的n(C)=0.07mol,n(H)=0.08mol,所以C个数是7,H个数是8,根据M=108,所以含有O的个数是1,即分子式为C7H80,
答案:C7H80;
(2)该有机物跟FeCl3溶液作用显紫色,则含有酚羟基,其一溴代物共有三种同分异构体,则含有三种类型的等效氢原子,有机物的结构简式为:![]() ;
;
答案::![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
I.CO+2H2![]() CH3OH II.CO2+3H2
CH3OH II.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
Ⅲ.CO2+H2![]() CO+H2O
CO+H2O
请回答下列问题:
(1)已知三种物质的标准燃烧热如下表:
物质 | CO(g) | H2(g) | CH3OH(l) |
燃烧热(kJ·mol1) | 283.0 | 285.8 | 726.51 |
①书写25℃、101kPa条件时CO燃烧热的热化学方程式______________________。
②计算25℃、101kPa条件时反应Ⅰ的ΔH=_____kJ·mol1 。
(2)直接甲醇燃料电池(Direct Methanol Fuel Cell)属于质子交换膜燃料电池,其工作原理如图所示:
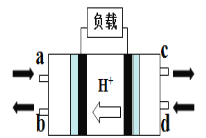
①c处产生的气体是________
②负极的电极反应式是____________。
(3)下图是甲醇燃料电池工作示意图,其中A,B,D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A,B两极上产生的气体体积相同。
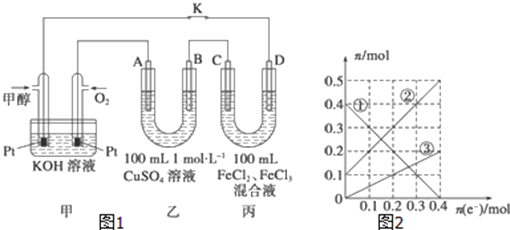
①乙中B极的电极反应式_______;
②乙中A极析出的气体在标况下的体积________;
③丙装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图,则③线表示的是____的变化,反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要____ml 5mol/L NaOH溶液。