题目内容
【题目】I.下面是7×18的格子,按要求作答。
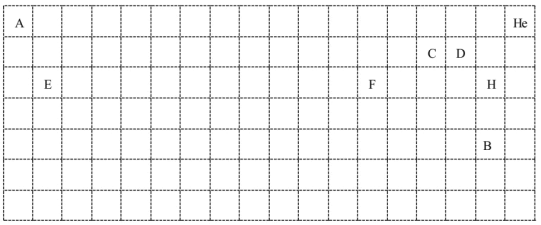
(1)用封闭的实线绘出元素周期表的轮廓。_______________
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大、温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素,已知这种元素的一种核素没有中子。你由此可知最先产生的元素是________ (填写元素名称),该元素的另一种核素,其中子数比质子数多1,此种核素的原子符号是________。
(3)C、D、E、F的简单离子半径由小到大的顺序是____________(填写离子符号)。
(4)请用电子式表示出E和H组成的化合物的形成过程:_________________。
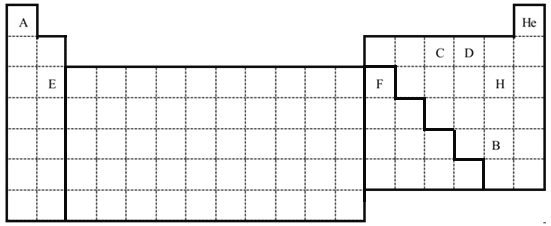
(5)用实线绘出金属与非金属的分界线;用实线绘出过渡元素的分界线。_____________
(6)请写出B形成的单质与氢气反应的化学方程式:______________。
(7)下列各种叙述中,正确的是__________。
a.化学键可分为离子键、共价键、极性键和非极性键四种类型
b.由非金属元素组成的化合物不一定是共价化合物
c.非极性键只存在于双原子单质分子里
d.在Na2S溶液中加入氯水,溶液中出现黄色沉淀,可以说明氯元素的非金属性比硫元素强
e.卤素氟、氯、溴、碘的氢化物的沸点由低到高的顺序为:HF<HCl<HBr<HI
f.构成单质分子的粒子不一定含有共价键
【答案】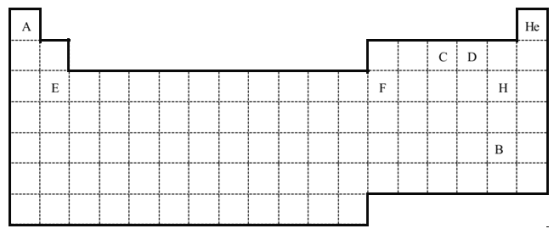 氢 13H Al3+<Mg2+<O2-<N3-
氢 13H Al3+<Mg2+<O2-<N3- ![]()
 I2+H2
I2+H2![]() 2HI bdf
2HI bdf
【解析】
(1)元素周期表有七个周期,18个纵行共16个族,根据元素周期表结构画出元素周期表的轮廓;
(2)不含中子的原子为氢原子,所以最先产生的元素是氢元素;氢元素中的另一种核素,其中子数比质子数多1,则质量数为1+2=3,该种核素的原子符号是13H;
(3)具有相同核外电子排布的离子,核电荷数越大,半径越小;
(4)Mg和Cl形成离子化合物MgCl2;
(5)元素周期表中在B、Si、As、Te、At和Al、Ge、Sb、Po之间的折线为金属与非金属的分界线;元素周期表中IIIB~IIB族的元素为过渡元素;
(6)碘与氢气在加热条件下反应生成HI,该反应为可逆反应,反应的化学方程式为:I2+H2![]() 2HI;
2HI;
(7)a.化学键可分为离子键、共价键,共价键分为极性键和非极性键;
b.由非金属元素组成的化合物不一定是共价化合物,如NH4Cl为离子化合物;
c.非极性键可能存在于共价化合物或离子化合物中,如H2O2和Na2O2中含有非极性键;
d.在Na2S溶液中加入氯水,溶液中出现黄色沉淀,发生置换反应,氯气作氧化剂,硫为氧化产物,可以说明氯元素的非金属性比硫元素强;
e.HF分子间形成氢键,沸点升高;
f.构成单质分子的粒子不一定含有共价键,如稀有气体为单原子分子,分子中不存在化学键。
(1)元素周期表有七个周期,18个纵行共16个族,用封闭的实线绘出元素周期表的轮廓为:
(2)不含中子的原子为氢原子,所以最先产生的元素是氢元素;氢元素中的另一种核素,其中子数比质子数多1,则质量数为1+2=3,该种核素的原子符号是13H,
故答案为:氢;13H;
(3)具有相同核外电子排布的离子,核电荷数越大,半径越小,N、O、Mg、Al的简单离子半径由小到大的顺序是Al3+<Mg2+<O2-<N3-,
故答案为:Al3+<Mg2+<O2-<N3-;
(4)Mg和Cl形成离子化合物MgCl2 ,用电子式表示形成过程为:![]() ,
,
故答案为:![]()
(5)元素周期表中在B、Si、As、Te、At和Al、Ge、Sb、Po之间的折线为金属与非金属的分界线;元素周期表中IIIB~IIB族的元素为过渡元素,用实线绘出过渡元素的分界线, ;
;
(6)碘与氢气在加热条件下反应生成HI,该反应为可逆反应,反应的化学方程式为:I2+H2![]() 2HI,
2HI,
故答案为:I2+H2![]() 2HI;
2HI;
(7)a.化学键可分为离子键、共价键,共价键分为极性键和非极性键,故a错误;
b.由非金属元素组成的化合物不一定是共价化合物,如NH4Cl为离子化合物,故b正确;
c.非极性键可能存在于共价化合物或离子化合物中,如H2O2和Na2O2中含有非极性键,故c错误;
d.在Na2S溶液中加入氯水,溶液中出现黄色沉淀,发生置换反应,氯气作氧化剂,硫为氧化产物,可以说明氯元素的非金属性比硫元素强,故d正确;
e.HF分子间形成氢键,沸点升高,故e错误;
f.构成单质分子的粒子不一定含有共价键,如稀有气体为单原子分子,分子中不存在化学键,故f正确。
综合以上分析,bdf正确,
故答案为:bdf。