题目内容
硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
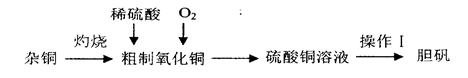
(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
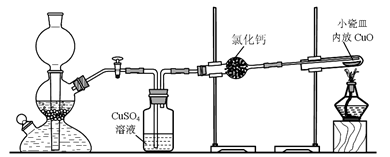
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。
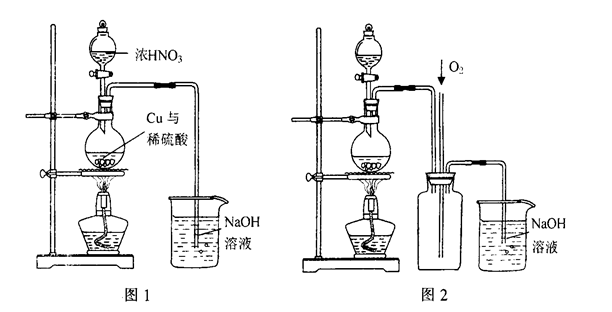
烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。

(1)操作I具体为__________、___________、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是___________(填字母代号)。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分.铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)若将杂铜换为纯净的铜粉,可直接向其中加入稀硫酸和Fe2(SO4)3溶液,不断通入氧气。反应完全后向其中加入过量_______________(填化学式,下同),调节pH至4,生成_________沉淀,过滤得硫酸铜溶液[已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4]。
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2=NaNO3+NaNO2+H2O)。

烧瓶内发生反应的离子方程式为____________________________________________;
图2是图1的改进装置,其优点有①__________________________,②_________________________。
(16分)(1)蒸发浓缩(2分);冷却结晶(2分) (2)ab(2分,选对1个1分,有错误不得分)
(3)CuO(2分,其它合理答案也可) Fe(OH)3(2分)
(4)Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑(2分,写对1个即得2分) ①防止NaOH溶液倒吸进入发生装置(2分) ②NO、NO2有毒气体能被完全吸收(2分)
(3)CuO(2分,其它合理答案也可) Fe(OH)3(2分)
(4)Cu+4H++2NO3-=Cu2++2H2O+2NO2↑;3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑(2分,写对1个即得2分) ①防止NaOH溶液倒吸进入发生装置(2分) ②NO、NO2有毒气体能被完全吸收(2分)
试题分析:(1)硫酸铜能溶于水,所以从硫酸铜溶液中得到硫酸铜晶体得操作应该是蒸发浓缩、冷却结晶,然后过滤烘干即可。
(2)灼烧后的产物除氧化铜还含少量铜,这说明a.灼烧过程中部分氧化铜被还原,a正确;b.灼烧不充分.铜未被完全氧化,b正确;c.氧化铜稳定,在加热过程中不可能分解生成铜,c不正确;d.铜极易被氧化生成氧化铜,d不正确,答案选ab。
(3)由于反应中不能再引入新的杂质,所以要调节溶液的pH小于进入氧化铜或氢氧化铜。由于氢氧化铁沉淀的pH小于氢氧化铜沉淀的pH,所以首先生成氢氧化铁沉淀,过滤得硫酸铜溶液。
(4)硝酸具有强氧化性,能把铜氧化生成硝酸铜,但随着反应的进行,硝酸浓度逐渐降低,其还原产物将逐渐变为NO,因此有关反应的化学方程式是Cu+4H++2NO3-=Cu2++2H2O+2NO2↑、3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑。由于NO2与氢氧化钠溶液反应时,溶液容易倒吸,且NO与氢氧化钠溶液不反应,易造成环境污染,所以图2中通入氧气可以氧化NO而不完全吸收,即装置2的优点是①防止NaOH溶液倒吸进入发生装置;②NO、NO2有毒气体能被完全吸收。

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目





 I2+I-;2S2O32-+I2=2I- + S4O62-)
I2+I-;2S2O32-+I2=2I- + S4O62-)