题目内容
下列装置或操作与实验目的最相符的是
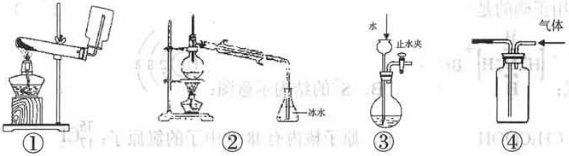

| A.①——实验室制取并收集足量NH3 |
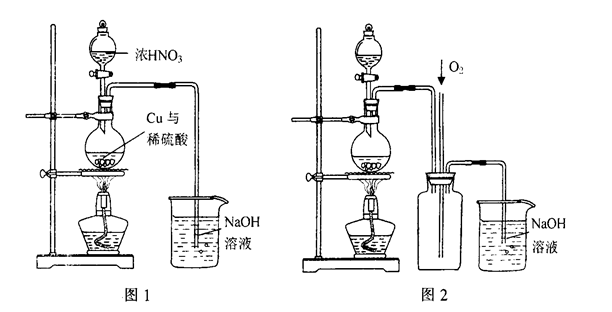
| B.②——以溴化钾、90%硫酸、乙醇为原料合成溴乙烷的装置 |
| C.③——检查装置气密性 |
| D.④——利用排空气法收集CO2 |
C
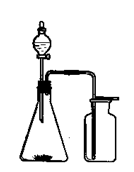
试题分析:A、收集氨气时不能为密封容器,且集气瓶口要塞一团蘸有稀硫酸的棉花团,图中收集装置不合理,故A错误;B、以溴化钾、90%硫酸、乙醇为原料合成溴乙烷,蒸馏得到溴乙烷,但乙醇易挥发,溴乙烷不纯,故B错误;C、由图中装置可知,关闭止水夹,从长颈漏斗加水,在长颈漏斗的下端能形成一段水柱,以此来检查装置的气密性,故C正确;D、二氧化碳的密度比空气的大,应利用向上排空气法收集,图中装置应长进短出,故D错误,答案选C。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目

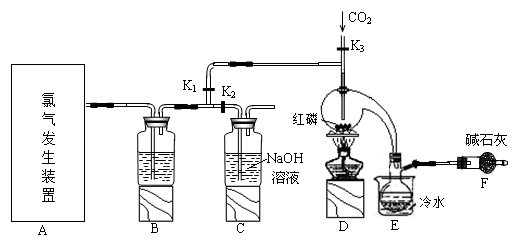
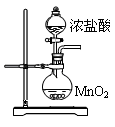
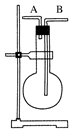
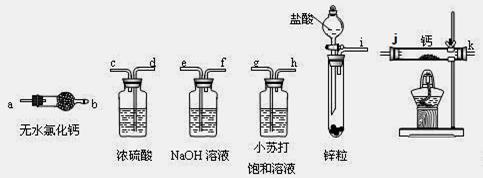
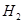 ②
②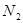 ③
③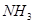 ④
④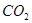 ⑤
⑤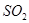 ⑥
⑥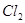 ,其中不能用排水法收集的气体是( )
,其中不能用排水法收集的气体是( )