题目内容
已知某反应中反应物与生成物有:KIO3、Na2SO3、H2SO4、I2、K2SO4、H2O 和未知物X。下列说法中不正确的是
| A.该未知物X为Na2SO4 |
| B.该反应的氧化剂是KIO3 |
| C.该反应中,发生氧化反应的过程是KIO3→I2 |
| D.由反应可知还原性强弱顺序为:Na2SO3>I2 |
C
解析试题分析:A、由题意可知发生反应的化学方程式为:2KIO3+ 5Na2SO3 +H2SO4= K2SO4+ 5Na2SO4+ I2+ H2O,从化学方程式可以看出,未知物X为Na2SO4,正确;B、该反应中反应物KIO3中的I(+5),生成物中I2碘元素的化合价为0,化合价降低,KIO3中碘的的化合价降低,被还原,自身做氧化剂,B正确、C错误;D、Na2SO3在反应中作还原剂,I2为还原产物,还原性:还原剂>还原产物,正确。
考点;考查氧化还原反应的有关概念、规律、化学方程的书写。

练习册系列答案
相关题目
给汽车安装尾气净化装置,汽车尾气通过净化装置(内有钯等过渡金属元素做催化剂)后,其中的有害气体CO、NO转化为无害气体N2、CO2,则
| A.NO作为还原剂 | B.CO作为还原剂 | C.N2作为还原剂 | D.CO2作为氧化剂 |
某溶液中阳离子只含K+,其中Cl-、Br-、I-的个数比为1∶2∶3,欲使这些离子个数比变为3∶2∶1,需要通入的氯分子与原溶液中I-的个数比应为( )
| A.1∶2 | B.2∶1 | C.1∶3 | D.3∶1 |
氧化还原反应与四种基本反应类型的关系如下图所示,则下列化学反应属于丙区域的是( )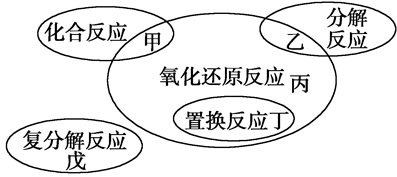
| A.Cl2+2KBr=Br2+2KCl | B.2NaHCO3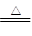 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
C.3Mg+N2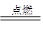 Mg3N2 Mg3N2 | D.2Na2O2+2CO2=2Na2CO3+O2 |
下列反应中,属于氧化还原反应的是
| A.CaCO3+2HCl=CaCl2+CO2↑+H2O |
| B.CaO+H2O=Ca(OH)2 |
C.2H2O2 2H2O+O2↑ 2H2O+O2↑ |
D.CaCO3 CaO+2CO2↑ CaO+2CO2↑ |
下列各组比较项目包含的数据关系中,前者比后者大的是( )
| A.氯水与氨水中微粒种数 |
| B.H2O2与O2分子中氧氧键键能 |
C.CH4分子与 离子中的键角 离子中的键角 |
| D.相同质量的铜片分别和过量浓硝酸、稀硝酸反应转移的电子数 |
下列反应中氯元素仅被还原的是
| A.5Cl2+I2+6H2O=10HCl+2HIO3 |
| B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
C.MnO2+4HCl(浓)  MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
| D.HCl+NaOH=NaCl+H2O |
已知:3S+6KOH 2K2S+K2SO3+3H2O,在反应中被还原的硫原子与被氧化的硫原子个数比为
2K2S+K2SO3+3H2O,在反应中被还原的硫原子与被氧化的硫原子个数比为
| A.1:1 | B.1:5 | C.1:2 | D.2:1 |