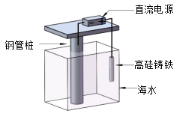
题目内容
【题目】CO用途广泛,工业应用时离不开平衡思想的指导:
Ⅰ.在某一容积为5L的体积不变的密闭容器内,加入0.3 mol 的CO和0.3mol的H 2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H20(g)CO2(g)+H2(g) △H>0,反应中CO2的浓度随时间变化情况如下图:
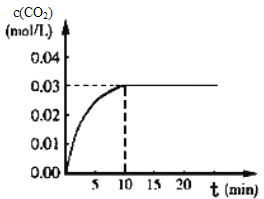
(1)根据图上数据,该温度(800℃)下的平衡常数K=____________________________。
(2)在体积不变的条件下,改变下列条件能使平衡常数K增大的有______________(填字母)
A.升高温度 B.降低温度
C.增大压强 D.减小压强
E.加入催化剂 G.移出一氧化碳气体
(3)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,H2O的转化率______________(填“升高”、“降低”、“不变”)。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L;c(CO2)=c(H2)= 0.13mol/L,则此时正、逆反应速率的大小:υ正______________υ逆(填“>”、“<”或“=”)。
Ⅱ、还原法炼铅,包含反应PbO(s)+CO(g)Pb(s)+C02(g) △H,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
(5)该反应的△H______________0(选填“>”、“〈”或“=”)。
(6)当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为____(保留两位有效数字);若向容器中充入一定量的CO气体后,平衡发生移动,再次达到平衡时,CO的百分含量______________(填“增大”、“减小”或“不变”)。
【答案】1 A 降低 < < 9.1% 不变
【解析】
(1)根据CO2的浓度变化求出CO的浓度变化,根据平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值进行解答;
(2)平衡常数只随温度的变化而变化,根据温度对平衡的影响分析;
(3)可逆反应中增大一种反应物的浓度,则另一种反应物的转化率会增大,而本身转化率减小;
(4)根据浓度商Qc=c(CO2)c(H2)/[c(CO)c(H2O)]与平衡常数K的大小关系判断。
(5)温度越高K值越小,说明该反应正反应为放热反应,△H<0;
(6)根据方程式进行计算;平衡正向移动,由于相当于加压,气体的分子数不变,所以再次达到平衡时,CO的百分含量不变。
Ⅰ.(1)在某一容积为5L的密闭容器内,加入0.3mol的CO和0.3mol的H2O,则起始浓度c(CO)=0.06mol/L,c(H2O)=0.06mol/L,平衡时c(CO2)=0.03mol/L,则
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度/mol·L-1: 0.06 0.06 0 0
转化浓度/mol·L-1: 0.03 0.03 0.03 0.03
平衡浓度/mol·L-1: 0.03 0.03 0.03 0.03
反应开始至达到平衡时,K=c(CO2)c(H2)/[c(CO)c(H2O)]=0.03×0.03/(0.03×0.03)=1;
故答案为:1。
(2)平衡常数只随温度的变化而变化,已知CO(g)+H2O(g)![]() CO2(g)+H2(g)△H>0,升高温度,平衡正向移动,平衡常数K增大,所以A正确,
CO2(g)+H2(g)△H>0,升高温度,平衡正向移动,平衡常数K增大,所以A正确,
故答案为:A。
(3)可逆反应中增大一种反应物的浓度,则另一种反应物的转化率会增大,而本身转化率减小,所以若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol的水蒸气,重新达到平衡后,CO的转化率升高,而水蒸气的转化率降低,
故答案为:降低。
(4)在催化剂存在和800℃的条件下,在某一时刻测得c(CO)=c(H2O)=0.09mol/L,c(CO2)=c(H2)=0.13mol/L,根据Qc=c(CO2)c(H2)/[c(CO)c(H2O)]=0.132/0.092=2.1>K=1,则反应逆向移动,所以υ正<υ逆,
故答案为:<。
Ⅱ.(5)lgK越大,K越大,温度越高K值越小,说明该反应正反应为放热反应,△H<0,
故答案为:<。
(6)当lgK=1时,K=10,在PbO(s)+CO(g)![]() Pb(s)+CO2(g)反应中,设起始CO:amol/L,达平衡时转化量为xmol/L,平衡时CO为(a-x)mol/L,CO2的浓度为xmol/L,则K=10=x/(a-x),即x=10a/11,达平衡时,混合气体中CO的体积分数为(a-x)/a×100%=9.1%,若向容器中充入一定量的CO气体后,平衡正向移动,由于相当于加压,气体的分子数不变,所以再次达到平衡时,CO的百分含量不变,
Pb(s)+CO2(g)反应中,设起始CO:amol/L,达平衡时转化量为xmol/L,平衡时CO为(a-x)mol/L,CO2的浓度为xmol/L,则K=10=x/(a-x),即x=10a/11,达平衡时,混合气体中CO的体积分数为(a-x)/a×100%=9.1%,若向容器中充入一定量的CO气体后,平衡正向移动,由于相当于加压,气体的分子数不变,所以再次达到平衡时,CO的百分含量不变,
故答案为:9.1%,不变。

【题目】下列有关实验操作与相应结论都正确的是![]()
选项 | 实验操作及现象 | 实验结论 |
A | 取少量硫酸亚铁铵晶体放入试管,加浓NaOH溶液,加热,试管口湿润蓝色石蕊试纸变红. | 可证明晶体的成分中含有 |
B | Z、W两试管中分别盛有pH和体积相同的盐酸和醋酸溶液,同时分别投入质量大小、形状相同的少量锌粒,Z中产生气体速率快 | Z中盛放的是醋酸 |
C | 向尿液中加入新制 | 说明尿液中不含有葡萄糖 |
D | 某待测液先滴入氯水无明显现象,后滴入硫氰化钾溶液出现血红色 | 该待测液中一定含有 |
A.AB.BC.CD.D
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)