题目内容
关于离子键和离子化合物的说法中,正确的是( )
| A、阴阳离子之间通过静电吸引形成离子键 |
| B、阴阳离子之间通过离子键一定能形成离子化合物 |
| C、离子化合物一定能导电 |
| D、只有在活泼金属元素与活泼非金属元素化合时,才能形成离子键 |
考点:离子化合物的结构特征与性质
专题:化学键与晶体结构
分析:A.阴阳离子之间通过静电作用形成离子键;
B.含有离子键的化合物是离子化合物;
C.含有自由移动离子的离子化合物能导电;
D.离子化合物可能全部是由非金属元素组成的.
B.含有离子键的化合物是离子化合物;
C.含有自由移动离子的离子化合物能导电;
D.离子化合物可能全部是由非金属元素组成的.
解答:
解:A.阴阳离子之间通过静电作用形成离子键,静电作用包含吸引力和排斥力,故A错误;
B.含有离子键的化合物是离子化合物,所以阴阳离子之间通过离子键一定能形成离子化合物,故B正确;
C.含有自由移动离子的离子化合物能导电,离子化合物中没有自由移动的离子就不能导电,如氯化钠晶体,故C错误;
D.离子化合物可能全部是由非金属元素组成的,如铵盐,故D错误;
故选B.
B.含有离子键的化合物是离子化合物,所以阴阳离子之间通过离子键一定能形成离子化合物,故B正确;
C.含有自由移动离子的离子化合物能导电,离子化合物中没有自由移动的离子就不能导电,如氯化钠晶体,故C错误;
D.离子化合物可能全部是由非金属元素组成的,如铵盐,故D错误;
故选B.
点评:本题考查了离子键的概念、离子化合物的组成元素及与导电的关系,注意不能根据是否含有金属元素判断离子化合物,离子化合物不一定导电,导电的不一定是离子化合物,注意它们的辩证关系,为易错点.

练习册系列答案
相关题目
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示.下列判断正确的是( )
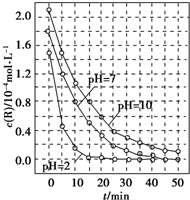

| A、在0-50 min之间,pH=2和PH=7时R的降解百分率不相等 |
| B、在20-25 min之间,pH=10 时R的平均降解速率为0.04 mol?L-1?min-1 |
| C、溶液酸性越强,R 的降解速率越小 |
| D、R的起始浓度和溶液的PH均影响R的降解速率 |
在2A(g)+B(g)?3C(g)+4D(g)的反应中,下列表示该反应速率最大的是( )
| A、VA=0.5mol/(L?min) |
| B、VB=0.3mol/(L?min) |
| C、VC=0.8mol/(L?min) |
| D、VD=0.04mol/(L?s) |
下列物质在溶于水和熔化时,破坏的作用力完全相同的是( )
| A、干冰 |
| B、冰醋酸 |
| C、NaHSO4 |
| D、KOH |
在催化剂存在下,1-丙醇可被氧化为另一种有机物X,下列有机物中与X互为同系物的是( )
| A、甲酸甲酯 | B、丙酮 |
| C、丙醛 | D、乙醛 |
共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:①NaOH;②SiO2;③碘;④金刚石;⑤NaCl;⑥干冰,其中含有两种作用力的组合是( )
| A、①②⑤ | B、①③⑥ |
| C、②④⑥ | D、①②③⑥ |
下列离子方程式书写正确的是( )
| A、在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ |
| B、NaHCO3溶液与盐酸的反应:CO32-+2H+═H2O+CO2↑ |
| C、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ |
| D、AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
物质发生化学变化时:①电子总数②原子总数③分子总数④物质的种类⑤物质的总质量⑥物质的总能量⑦原子种类,反应前后肯定不发生变化的是( )
| A、①②③⑤ | B、①②⑤⑦ |
| C、②⑤⑥ | D、①④⑤⑥ |
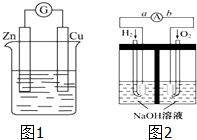 Ⅰ、如图1所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是
Ⅰ、如图1所示,烧杯中盛放的溶液为盐酸,接通电流表G后,指针发生偏转,则负极材料是