题目内容
【题目】氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题:
(1)氨气的制备
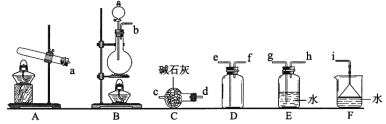
①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为_____________________________________________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______→______→_____→i(按气流方向,用小写英文字母表示)。
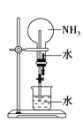
③可用如图装置进行氨的喷泉实验,引发喷泉的操作是_______________________________。
(2)如图所示,NH3经一系列反应可以得到HNO3。

①反应①的化学方程式为________________________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式为_______________________。
(3)在某100mL硝酸与硫酸的混合液中,HNO3和H2SO4的物质的量浓度分别为0.6 mol·L-1和0.3mol·L-1。向该混合液中加入3.84g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度为____________。
【答案】A或B Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O或NH3H2O
CaCl2+2NH3↑+2H2O或NH3H2O![]() NH3↑+H2O d c f e 挤压胶头滴管的水进入圆底烧瓶,再打开止水夹 4NH3+5O2
NH3↑+H2O d c f e 挤压胶头滴管的水进入圆底烧瓶,再打开止水夹 4NH3+5O2![]() 4NO+6H2O 4NH3+6NO
4NO+6H2O 4NH3+6NO![]() 5N2+6H2O 0.45mol/L
5N2+6H2O 0.45mol/L
【解析】
(1)①实验室利用氯化铵固体和消石灰共热反应制备氨气或利用浓氨水受热分解制备氨气;
②按照制取→除杂→干燥→收集→尾气处理的顺序分析解答;
③氨的喷泉实验的原理是氨极易溶于水,致使烧瓶内气体物质的量减小,压强迅速减小,导致溶液进入烧瓶产生喷泉现象;
(2)①反应①为在催化剂、加热条件下,氨气被氧化生成NO和水;
②在400℃左右且有催化剂存在的情况下,氨与一氧化氮发生氧化还原反应生成无色无毒的氮气和水;
(3)铜和混酸反应,实际上是与硝酸反应,反应的离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,由题给数据可知,反应时铜和硝酸根过量,氢离子不足量,则依据氢离子的量计算溶液中铜离子的量。
(1)①实验室利用氯化铵固体和消石灰共热反应制备氨气,该反应为固体与固体共热的反应,应该选择A装置,反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;或选择装置B,利用浓氨水受热分解制备氨气,反应的化学方程式为NH3H2O
CaCl2+2NH3↑+2H2O;或选择装置B,利用浓氨水受热分解制备氨气,反应的化学方程式为NH3H2O![]() NH3↑+H2O,故答案为:A或B;Ca(OH)2+2NH4Cl
NH3↑+H2O,故答案为:A或B;Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O或NH3H2O
CaCl2+2NH3↑+2H2O或NH3H2O![]() NH3↑+H2O;
NH3↑+H2O;
②按照制取→除杂→干燥→收集→尾气处理的顺序可知,收集一瓶干燥的氨气的装置连接顺序为A(或B)→C(干燥)→D(收集)→F(尾气处理),注意干燥管是大口进小口出,氨气密度小于空气,应用向下排空气法收集,收集氨气时应从短管进入,则按气流方向的顺序为a或b→d→c→f→e→i,故答案为:d;c ;f;e;
③氨的喷泉实验的原理是氨极易溶于水,打开止水夹挤出胶头滴管中的水,然后打开止水夹,由于氨气迅速溶解在挤出胶头滴管中的水,致使烧瓶内气体物质的量减小,压强迅速减小,导致溶液进入烧瓶产生喷泉现象,故答案为:挤压胶头滴管的水进入圆底烧瓶,再打开止水夹;
(2)①反应①为在催化剂、加热条件下,氨气被氧化生成NO和水,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
②在400℃左右且有催化剂存在的情况下,氨与一氧化氮发生氧化还原反应生成无色无毒的氮气和水,反应的化学方程式为4NH3+6NO![]() 5N2+6H2O,故答案为:4NH3+6NO
5N2+6H2O,故答案为:4NH3+6NO![]() 5N2+6H2O;
5N2+6H2O;
(3)铜和混酸反应,实际上是与硝酸反应,反应的离子方程式为3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2O,3.84g铜的物质的量为![]() =0.06mol,HNO3和H2SO4的物质的量浓度分别为0.6 mol·L-1和0.3mol·L-1的100mL混合液中,硝酸根的物质的量为0.06mol,氢离子的物质的量为(0.06mol+0.03mol×2)=0.12mol,由离子方程式可知,反应时铜和硝酸根过量,氢离子不足量,则依据氢离子的量计算溶液中铜离子的量,由8n(Cu2+)=3n(H+)可得n(Cu2+)=
=0.06mol,HNO3和H2SO4的物质的量浓度分别为0.6 mol·L-1和0.3mol·L-1的100mL混合液中,硝酸根的物质的量为0.06mol,氢离子的物质的量为(0.06mol+0.03mol×2)=0.12mol,由离子方程式可知,反应时铜和硝酸根过量,氢离子不足量,则依据氢离子的量计算溶液中铜离子的量,由8n(Cu2+)=3n(H+)可得n(Cu2+)=![]() =0.045mol,则所得溶液中的Cu2+的物质的量浓度为0.45mol/L,故答案为:0.45mol/L。
=0.045mol,则所得溶液中的Cu2+的物质的量浓度为0.45mol/L,故答案为:0.45mol/L。

 名校课堂系列答案
名校课堂系列答案【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
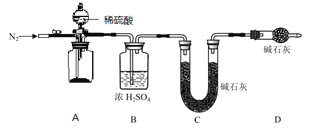
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________


