题目内容
Ⅰ.溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色。某同学将稀溴水和稀FeCl2溶液混合,所得溶液显黄色。为探究溴水和FeCl2溶液混合能否发生反应,该同学设计了以下实验方案:
| 操作 | 实验现象 | 实验结论 | |
| 方案1 | 取少量混合溶液,加入NaOH溶液,振荡 | 得到红褐色沉淀 | 发生了化学反应 |
| 方案2 | 取少量混合溶液,加入四氯化碳溶液,振荡 | 有机层呈橙黄色 | 未发生化学反应 |
| 方案3 | 取少量混合溶液,加入淀粉碘化钾溶液,振荡 | 溶液变蓝色 | 未发生化学反应 |
请回答下列问题:
(1)方案2的结论不合理,其理由是
(2)方案3的结论明显不合理,可能发生反应的离子方程式
(3)请另外设计一个简单的实验方案(包括“操作”“现象”“结论”),判断溴水和FeCl2溶液是否反应。
。
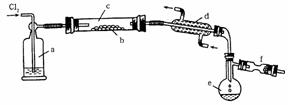 Ⅱ.S2Cl2是一种易挥发的液体(熔点:-76℃,沸点:138℃),且易与水发生水解反应,可能生成H2S、SO2、H2SO3、H2SO4等物质。它是橡胶硫化剂。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
Ⅱ.S2Cl2是一种易挥发的液体(熔点:-76℃,沸点:138℃),且易与水发生水解反应,可能生成H2S、SO2、H2SO3、H2SO4等物质。它是橡胶硫化剂。在熔融的硫中通以氯气即可生成S2Cl2。下图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去)。
(1)装置a中应放试剂为__________;装置d的名称是_________,它的作用是_________。
(2)该实验的操作顺序应为__________(用序号表示)。
①加热装置c ②通入Cl2 ③通冷凝水 ④停止通Cl2 ⑤停止加热装置c
(3)将S2Cl2的水解气体产物通入氯水中,若观察到_________的现象,则可证明水解产物中有硫化氢生成。
Ⅰ(1)溴水可能过量(2分) (2)2Fe3++2I-=2Fe2++I2 Br2+2I-=I2+2Br-(2分)
(3) 取少量黄色溶液于试管中,滴加KSCN溶液,若溶液变血红色,则说明Br2与FeCl2溶液发生了反应(2分)
Ⅱ(1)浓硫酸(1分) 冷凝管(1分) 使S2Cl2液化(1分)
(2)③②①⑤④(或②③①⑤④)(2分) (3)有淡黄色的浑浊产生(1分)

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 实验操作 | 实验现象 | 结论 | |
| 方案1 | 取少量混合溶液,加入NaOH溶液 | 最终得到红褐色沉淀, | 溴水和FeCl2溶液发生了化学反应 |
| 方案2 | 取少量混合溶液,加入淀粉碘化钾溶液 | 溶液变蓝色 | 溴水和FeCl2溶液未发生化学反应 |
(1)方案1的结论是否合理?
(2)方案2的结论明显不合理,写出其中可能发生反应的离子方程式
(3)请你设计一个简单的实验方案,判断溴水和FeCl2溶液是否反应(写出实验操作、实验现象和结论):