题目内容
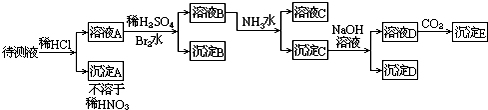
(1)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是
①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
①方案1的结论是否合理
②方案2的结论明显不合理,可能发生反应的离子方程式为
③方案3的结论也不合理,理由是
④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是
Al3+、NH4+
Al3+、NH4+
,一定没有的阳离子是Fe3+
Fe3+
.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)焰色反应
焰色反应
,现象是透过蓝色钴玻璃呈紫色
透过蓝色钴玻璃呈紫色
.(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是
①②③
①②③
(用选项符号表示).①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
| 操作 | 实验现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH | 最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 溶液变蓝色,说明未发生化学反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 下层溶液呈橙红色,说明未发生化学反应 |
不合理
不合理
(填“合理”或“不合理”).②方案2的结论明显不合理,可能发生反应的离子方程式为
Br2+2I-=I2+2Br-
Br2+2I-=I2+2Br-
.③方案3的结论也不合理,理由是
溴水可能过量
溴水可能过量
.④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):
取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+
取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+
.分析:(1)取少量溶液呈无色判断,溶液中一定不含Fe3+;向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.证明生成的沉淀是氢氧化铝,氢氧化铝溶解于氢氧化钠溶液中,证明原溶液中含Al3+;产生的气体根据现象变化判断为是氨气,原溶液中含NH4+;未检出的阳离子是K+离子;利用金属元素的焰色反应进行验证;
(2)a溶液由浅绿色(近乎无色)变成黄色.,加入溴水的溶液,溴单质浓度较小时,溶液均呈黄色;Fe3+的溶液呈黄色;溶液颜色改变的原因可能为溴单质的颜色、或三价铁离子的颜色或二者混合形成的颜色;
b进一步探究溴水和FeSO4溶液是否发生了反应的实验过程,依据步骤和反应现象分析判断;生成三价铁离子是最简单的检验方法;检验溴的存在判断,溴单质可能反应后过量,也可以不反应都会产生对应现象;检验时加入氢氧化钠溶液最终生成红褐色沉淀,可以是氢氧化亚铁氧化得到.
(2)a溶液由浅绿色(近乎无色)变成黄色.,加入溴水的溶液,溴单质浓度较小时,溶液均呈黄色;Fe3+的溶液呈黄色;溶液颜色改变的原因可能为溴单质的颜色、或三价铁离子的颜色或二者混合形成的颜色;
b进一步探究溴水和FeSO4溶液是否发生了反应的实验过程,依据步骤和反应现象分析判断;生成三价铁离子是最简单的检验方法;检验溴的存在判断,溴单质可能反应后过量,也可以不反应都会产生对应现象;检验时加入氢氧化钠溶液最终生成红褐色沉淀,可以是氢氧化亚铁氧化得到.
解答:解:(1)取少量溶液呈无色判断,溶液中一定不含Fe3+;向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.证明生成的沉淀是氢氧化铝,氢氧化铝溶解于氢氧化钠溶液中,证明原溶液中含Al3+;产生的气体根据现象变化判断为是氨气,原溶液中含NH4+;未检出的阳离子是K+离子;利用金属元素的焰色反应进行验证,透过蓝色钴玻璃呈紫色证明含有钾离子,
故答案为:Al3+、NH4+;Fe3+;焰色反应;透过蓝色钴玻璃呈紫色;
(2)a溶液由浅绿色(近乎无色)变成黄色.,加入溴水的溶液,溴单质浓度较小时,溶液均呈黄色;Fe3+的溶液呈黄色;溶液颜色改变的原因可能为溴单质的颜色、或三价铁离子的颜色或二者混合形成的颜色,所以选项溶液颜色发生改变的原因可能是①②③;故答案为:①②③;
①取少量黄色溶液,加入NaO最终生成红褐色沉淀,不一定说明溴水和FeSO4溶液发生了化学反应,因为氢氧化钠和亚铁离子反应生成的氢氧化亚铁白色沉淀会迅速变为灰绿色最后生成红褐色沉淀氢氧化铁,所以不合理,故答案为:不合理;
②取少量黄色溶液,加入淀粉碘化钾溶液,溶液变蓝色,不一定说明未发生化学反应,因为溴单质与亚铁离子反应生成的三价铁离子会氧化碘离子生成单质碘,溴单质过量也可以出现此现象,发生的可能反应为:Br2+2I-=I2+2Br-,故答案为:Br2+2I-=I2+2Br-;
③取少量黄色溶液,加入四氯化碳,振荡,下层溶液呈橙红色,不一定说明未发生化学反应,若溴水过量,加入四氯化碳也会发生上述现象,故答案为:溴水可能过量;
④判断溴水和FeSO4溶液是否反应的最简单方法是只需检验有无三价铁离子生成就可以证明发生反应,方法为:取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+,
故答案为:取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+.
故答案为:Al3+、NH4+;Fe3+;焰色反应;透过蓝色钴玻璃呈紫色;
(2)a溶液由浅绿色(近乎无色)变成黄色.,加入溴水的溶液,溴单质浓度较小时,溶液均呈黄色;Fe3+的溶液呈黄色;溶液颜色改变的原因可能为溴单质的颜色、或三价铁离子的颜色或二者混合形成的颜色,所以选项溶液颜色发生改变的原因可能是①②③;故答案为:①②③;
①取少量黄色溶液,加入NaO最终生成红褐色沉淀,不一定说明溴水和FeSO4溶液发生了化学反应,因为氢氧化钠和亚铁离子反应生成的氢氧化亚铁白色沉淀会迅速变为灰绿色最后生成红褐色沉淀氢氧化铁,所以不合理,故答案为:不合理;
②取少量黄色溶液,加入淀粉碘化钾溶液,溶液变蓝色,不一定说明未发生化学反应,因为溴单质与亚铁离子反应生成的三价铁离子会氧化碘离子生成单质碘,溴单质过量也可以出现此现象,发生的可能反应为:Br2+2I-=I2+2Br-,故答案为:Br2+2I-=I2+2Br-;
③取少量黄色溶液,加入四氯化碳,振荡,下层溶液呈橙红色,不一定说明未发生化学反应,若溴水过量,加入四氯化碳也会发生上述现象,故答案为:溴水可能过量;
④判断溴水和FeSO4溶液是否反应的最简单方法是只需检验有无三价铁离子生成就可以证明发生反应,方法为:取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+,
故答案为:取少量溶液,滴加KSCN溶液呈血红色,FeSO4与溴水反应生成Fe3+.
点评:本题考查了常见离子的检验方法分析,现象的判断应用,反应的产物判断,主要是反应是否进行的实验设计方案的假设和验证,铁及其化合物性质的应用,离子检验方法是解题关键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
(1)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是______,一定没有的阳离子是______.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)______,现象是______.
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是______(用选项符号表示).
①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
| 操作 | 实验现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH | 最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 溶液变蓝色,说明未发生化学反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 下层溶液呈橙红色,说明未发生化学反应 |
②方案2的结论明显不合理,可能发生反应的离子方程式为______.
③方案3的结论也不合理,理由是______.
④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):______.
(1)某待测液中可能含有A13+、Fe3+、K+、NH4+、C1-等离子,现通过如下实验对其中的阳离子进行检验:
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是______,一定没有的阳离子是______.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)______,现象是______.
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是______(用选项符号表示).
①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
①方案1的结论是否合理______(填“合理”或“不合理”).
②方案2的结论明显不合理,可能发生反应的离子方程式为______.
③方案3的结论也不合理,理由是______.
④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):______.
a取少量待测液,仔细观察,呈无色;
b向上述待测液中滴加NaOH溶液,有白色沉淀生成,NaOH溶液过量后沉淀又完全溶解.实验过程中还有刺激性气味的气体产生,该气体能使湿润的红色石蕊试纸变蓝.
据此可以判断该待测液中一定含有的阳离子是______,一定没有的阳离子是______.还有一种阳离子没有检验,检验这种离子的实验方法是(填写实验名称)______,现象是______.
(2)溴水和氯化铁溶液是中学化学实验中的常用试剂,浓度较小时,溶液均呈黄色.某同学在探究铁的化合物的相互转化时,进行了如下实验.请你参与讨论.
实验操作:向20mL的FeSO4溶液中,滴加浓溴水,振荡.
实验现象:溶液由浅绿色(近乎无色)变成黄色.
a溶液颜色发生改变的原因可能是______(用选项符号表示).
①使溶液呈黄色的微粒是Br2
②使溶液呈黄色的微粒是Fe3+
③使溶液呈黄色的微粒是Fe3+和Br2
b为进一步探究溴水和FeSO4溶液是否发生了反应,下列是该同学设计的一些实验方案:
| 操作 | 实验现象及结论 | |
| 方案1 | 取少量黄色溶液,加入NaOH | 最终生成红褐色沉淀,说明溴水和FeSO4溶液发生了化学反应 |
| 方案2 | 取少量黄色溶液,加入淀粉碘化钾溶液 | 溶液变蓝色,说明未发生化学反应 |
| 方案3 | 取少量黄色溶液,加入四氯化碳,振荡 | 下层溶液呈橙红色,说明未发生化学反应 |
②方案2的结论明显不合理,可能发生反应的离子方程式为______.
③方案3的结论也不合理,理由是______.
④你认为判断溴水和FeSO4溶液是否反应的最简单方法是(填“操作”“现象”“结论”):______.