题目内容
【题目】已知某无色透明溶液中仅含有包括Na+和CH3COO-在内的四种离子。
请回答下列问题。
(1)该溶液中的溶质可能有三种情况,请分别写出各种情况的化学式:
①_____________________;②________________________;③____________________ 。
(2)25℃,若由0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合,测得混合溶液的pH=8,则c(CH3COOH)+c(H+)的精确值为___________________mol/L。
(3)若该溶液的pH=8,则c(Na+)-c(CH3COO-)的精确值为___________________mol/L。
(4)当溶液中各离子浓度大小的顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,则该溶液可能是____(填序号);
A.由0.1 mol/L的CH3COONa溶液与0.1 mol/L的CH3COOH溶液等体积混合而成
B.由0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合而成
C.由0.2 mol/L的CH3COONa溶液与0.1 mol/L的HCl溶液等体积混合而成
D.由0.2 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液等体积混合而成
(5)常温下,将a mol/L的CH3COOH溶液与0.01 mol/L的NaOH溶液等体积混合,反应平衡后溶液中c(Na+)=c(CH3COO-),用含a的代数式表示CH3COOH的电离平衡常数Ka=_________。
【答案】CH3COONa CH3COONa和CH3COOH CH3COONa和NaOH 1×10-6 9.9×10-7 AD 1×10-9/(a-0.01)
【解析】
本题考查离子浓度的大小比较以及弱电解质的电离平衡常数的相关计算等问题,题目难度较大,注意根据溶液离子浓度的关系结合弱电解质的电离等知识解答。
(1)能电离出醋酸根离子的物质可以是醋酸和醋酸钠,能电离出钠离子的物质可以是氢氧化钠和醋酸钠,所以当溶液中含有Na+和CH3COO-在以及OH-、H+时,溶液中溶质的组成可以是:①CH3COONa、CH3COONa和CH3COOH、CH3COONa和NaOH,
故答案为:CH3COONa;CH3COONa和CH3COOH;CH3COONa和NaOH。
(2)25℃,若由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH=8,由质子守恒可知:c(CH3COOH)+c(H+)=c(OH-)=1×10-6,
故答案为:1×10-6。
(3)溶液中存在电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),所以c(Na+)-c(CH3COO-)=c(OH-)-c(H+)=106 mol/L - 108mol/L =(10-6-10-8)mol/Lmol/L=9.9×10-7mol/L,
故答案为:9.9×10-7。
(4)A.等浓度的CH3COONa和醋酸混合溶液中,醋酸的电离程度大于醋酸根离子的水解程度,所以离子的浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故符合;
B.醋酸钠溶液中,钠离子浓度大于醋酸根浓度,故不符合;
C.由0.2mol/L的CH3COONa溶液与0.1mol/L的HCl溶液等体积混合而成,得到物质的量浓度相等的醋酸、醋酸钠和氯化钠,钠离子浓度大于醋酸根浓度,故不符合;
D.由0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成,得到等物质的量浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解程度,所以离子的浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故符合;
故选:AD。
(5)常温下,将a mol/L的CH3COOH溶液与0.01mol/L的NaOH溶液等体积混合,反应平衡后溶液中c(Na+)=c(CH3COO-),根据电荷守恒得c(OH-)=c(H+),溶液呈中性,又电离平衡常数![]() ,c(H+)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,c(CH3COOH)=
,c(H+)=10-7mol/L,c(Na+)=c(CH3COO-)=0.005mol/L,c(CH3COOH)=![]() mol/L,则Ka=
mol/L,则Ka=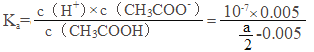 =1×10-9/(a-0.01)
=1×10-9/(a-0.01)
故答案为:1×10-9/(a-0.01)。





