题目内容
【题目】下列说法正确的是( )
A.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液中:c(Na+)<c(NO3- )
B.25 ℃时,向水中加入少量固体CH3COONa,水的电离平衡OH-正向移动,n(OH-)降低
C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,分别加入0.3 g锌粉,醋酸生成的氢气比盐酸多
D.已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中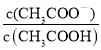 值增大
值增大
【答案】D
【解析】
A.NaNO3是强电解质,和稀盐酸混合后,Na+、NO3-离子也不与H+、 Cl-结合,在这个混合溶液中都是以离子形态存在,所以Na+、NO3-的浓度是相同的,故A选项错误。
B.25℃时向水中加入少量固体CH3COONa,醋酸根离子结合水电离的氢离子,水的电离平衡向着正向移动,n(OH-)增加,故B选项错误。
C.取c(H+)=0.01 mol·L-1的盐酸和醋酸各100 mL,则H+的物质的量为0.001mol,0.3g锌粉的物质的量为0.0046mol,故盐酸与醋酸均足量,生成的氢气的体积只与锌粉的物质的量有关,故C选项错误。
D.0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,则
CH3COO-+H+,则![]() ,故得出
,故得出![]() 加少量烧碱溶液后消耗氢离子,故
加少量烧碱溶液后消耗氢离子,故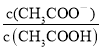 值增大,故D选项正确。
值增大,故D选项正确。
故答案选D。

【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中先加入氯水再加入KSCN溶液 | 溶液呈红色 | 原溶液中一定含 |
B | 向盛有 | 试管口出现红棕色气体 |
|
C | 向 | 出现白色胶状沉淀 | 碳的非金属性强于硅的 |
D | 用一束强光照射淀粉溶液 | 产生光亮的“通路” | 淀粉发生水解生成了胶体 |
A.AB.BC.CD.D