题目内容
下列关于元素周期表和元素性质的叙述正确的是
| A.质子数相同的微粒之间一定互称同位素 |
| B.I A族与ⅦA族元素间形成的化合物一定是离子化合物 |
| C.同主族元素的简单阴离子半径越大,其单质氧化性越弱 |
| D.同周期金属元素的化合价越高,其氢氧化物的碱性越强 |
C
解析试题分析:A、微粒包括分子、原子、离子等,如H2O、NH3分子质子数相同,但不是同位素,错误;B、I A族与ⅦA族元素间形成的化合物也有可能为共价化合物,如HF、HCl、HBr等,错误;C、同主族元素的简单阴离子半径越大,说明元素的原子序数越大,其单质氧化性越弱,正确;D、同周期金属元素的化合价越高,其氢氧化物的碱性越弱,错误。
考点:本题考查基本概念、元素周期律。

卤素单质可以参与很多化学反应, 如:NF3可由NH3和F2在Cu催化剂存在下反应直接得到;反应①: 2NH3+3F2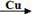 NF3+ 3NH4F
NF3+ 3NH4F
利用“化学蒸气转移法”制备TaS2晶体; 反应②:TaI4(g)+S2(g)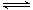 TaS2(s)+2I2(g)+Q kJ,Q>0
TaS2(s)+2I2(g)+Q kJ,Q>0
(1)反应①中:非金属性最强的元素原子核外有_________种不同运动状态的电子;该反应中的某元素的单质可作粮食保护气,则该元素最外层的电子有____________种自旋方向。
(2)反应①中:物质所属的晶体类型有________________________________;
并写出所有原子符合8电子稳定结构的化合物的电子式_______________________。
(3)反应②中:平衡常数表达式K=_____________________,若反应达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 ______________。
| A.平衡常数K增大 | B.S2的浓度减小 | C.I2的质量减小 | D.V(TaI4)逆 增大 |
(5)某同学对反应②又进行研究,他查阅资料,发现硫单质有多种同素异形体,可表示Sx,且在一定条件下可以相互转化,他认为仅增大压强对平衡是有影响的,则TaI4的平衡转化率会____________(填增大或减小),其原因是________________________ 。
下列比较不正确的是
| A.最高价氧化物对应水化物的酸性:H3PO4>H2SO4>HNO3 |
| B.与冷水的反应速率:K>Na>Mg |
| C.热稳定性:HF>HCl>H2S |
| D.离子半径:Cl->F->Na+ |
X元素原子的质量数为m,核内中子数为n,则W g X+含有电子的物质的量(mol)是( )。
| A.(m-n)×W/m | B.(m-n-1)×W/m | C.(m+n)×W/m | D.(m-n+1)×W/m |
下列叙述正确的是( )
| A.乙酸与丙二酸互为同系物 |
| B.不同元素的原子构成的分子只含极性共价键 |
C.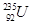 和 和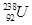 是中子数不同质子数相同的同种核素 是中子数不同质子数相同的同种核素 |
| D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
在短周期元素中,若某元素原子的最外层电子数与其电子层数相等,则符合条件的元素种数为( )。
| A.1种 | B.2种 | C.3种 | D.4种 |
下列元素中价电子排布不正确的是( )
| A.V:3d34s2 | B.Cr:3d44s2 | C.Ar:3s23p6 | D.Ni:3d84s2 |
X、Y、Z为短周期元素,原子序数依次增大。X的最外层电子数是Y原子最外层电子数的2倍,质子数比Y少5,X、Z在同主族。下列叙述不正确的是( )
| A.原子半径:Y>Z |
| B.X元素的一种单质可用于消毒杀菌 |
| C.Y的氧化物是工业制取Y单质的主要原料 |
| D.Z的单质在氧气中点燃可生成两种酸性氧化物 |
若短周期的两元素可形成原子个数比为2∶3的化合物,则这两种元素原子序数之差不可能是( )。
| A.1 | B.3 | C.5 | D.6 |