题目内容
在短周期元素中,若某元素原子的最外层电子数与其电子层数相等,则符合条件的元素种数为( )。
| A.1种 | B.2种 | C.3种 | D.4种 |
C
解析

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
下列叙述正确的是
| A.同周期元素的原子半径以VIIA族的为最大 |
| B.同主族元素两种元素原子的核外电子数的差值可能为26 |
| C.短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素 |
| D.科学家在周期表中金属与非金属的分界线处找到了优良的催化剂 |
下列关于元素周期表和元素性质的叙述正确的是
| A.质子数相同的微粒之间一定互称同位素 |
| B.I A族与ⅦA族元素间形成的化合物一定是离子化合物 |
| C.同主族元素的简单阴离子半径越大,其单质氧化性越弱 |
| D.同周期金属元素的化合价越高,其氢氧化物的碱性越强 |
下列所述变化规律正确的是
| A.Na、Mg、Al还原性依次增强 |
| B.HCl、PH3、H2S稳定性依次减弱 |
| C.NaOH、KOH、CsOH碱性依次增强 |
| D.S2-、Cl-、K+、Ca2+离子半径依次增大 |
周期表中前20号元素X、Y、Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数比Y元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子。下列有关说法正确的是
| A.离子半径:X+ >Y- |
| B.Z元素的最高正化合价与最低负化合价代数和为4 |
| C.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物 |
| D.Y的氢化物中存在离子键 |
下列叙述中正确的是( )
| A.在1s、2px、2py、2pz轨道中,具有球对称性的是1s轨道 |
| B.4f、4s、3d原子轨道的能量关系是:E(4f)>E(4s)>E(3d) |
| C.磷原子的3个3p电子所在原子轨道的能量关系是:E(3px)<E(3py)<E(3pz) |
| D.CH2=CH2分子中,碳原子的2px轨道上的电子与氢原子的1s电子形成C—Hσ键 |
五种短周期金属元素在元素周期表中的相对位置如图所示,下列判断正确的是( )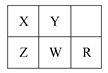
| A.原子半径:Z<W<R |
| B.金属性:X>Z |
| C.氢氧化物的碱性:Z>W>R |
| D.最外层电子数:X>Y |
下列说法中不正确的是 ( )
| A.同周期元素,随着核电荷数的增加,I1总体上呈现由小到大的变化趋势 |
| B.电离能越大,表示气态时该原子越易失电子 |
| C.元素的电负性越大,表示其原子在化合物中吸引电子能力越强 |
| D.电负性是相对的,所以没有单位 |
元素的原子半径在周期表中呈现周期性变化的根本原因是( )。
| A.原子的相对原子质量呈现周期性变化 |
| B.元素的化合价呈现周期性变化 |
| C.原子的性质呈现周期性变化 |
| D.元素原子的核外电子排布呈周期性变化 |