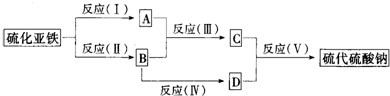
题目内容
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系知图所示.

请回答下列问题:
(1)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,则B的化学式可能为
(2)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,则A的电子式为
 ,B的结构式为
,B的结构式为
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂.
①25℃时,pH均为10的A、B两溶液中,由水电离出的氢氧根离子浓度之比为
②25℃时,0.1mol?L-1的A、B、C三种溶液,分别用水稀释不同的倍数后,溶液的pH相同,则稀释后溶液的物质的量浓度最大的是
③将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小顺序为

请回答下列问题:
(1)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,则B的化学式可能为
FeCl3或Fe(NO3)3
FeCl3或Fe(NO3)3
.(写出一种即可)(2)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,则A的电子式为


N≡N
N≡N
.(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂.
①25℃时,pH均为10的A、B两溶液中,由水电离出的氢氧根离子浓度之比为
10-6:1或1:106
10-6:1或1:106
②25℃时,0.1mol?L-1的A、B、C三种溶液,分别用水稀释不同的倍数后,溶液的pH相同,则稀释后溶液的物质的量浓度最大的是
NaHCO3
NaHCO3
溶液(填溶质的化学式).③将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小顺序为
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
.分析:(1)若D为用量最大、用途最广的金属单质为Fe,加热蒸干B的溶液没有得到B的盐,说明该盐对应的酸为挥发性酸,则B的化学式可能为FeCl3 或Fe(NO3)3;
(2)B和D为空气的主要成分,则为N2和O2,根据A→B→C的反应中都有D参加反应,则D应为O2,B为N2,转化关系为:
NH3
N2
→NO,则A为 NH3,以此书写电子式和结构式;
(3)若D为氯碱工业的重要产品,应为NaOH,能与NaOH连续反应的物质反应的转化关系为Al3+
Al(OH)3
AlO2-,则反应(Ⅲ)的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)①若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,则C为NaHCO3,A、B、C的转化关系为
NaOH
Na2CO3
NaHCO3,25℃时,pH均为10的NaOH、Na2CO3两溶液中,由水电离出的氢氧根离子浓度分别为:NaOH:c(OH-)=10-10mol/L,Na2CO3:c(OH-)=10-4mol/L,以此计算离子浓度关系;
②因为NaOH是强碱,在溶液中完全电离,而Na2CO3,NaHCO3是弱酸强碱盐,是在水的作用下而发生水解显碱性,
Na2CO3,NaHCO3水解的程度只是少部分,并且Na2CO3大于NaHCO3水解程度,以此判断水解程度大小;
③将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),以此判断离子浓度大小.
(2)B和D为空气的主要成分,则为N2和O2,根据A→B→C的反应中都有D参加反应,则D应为O2,B为N2,转化关系为:
NH3
| O2 |
| O2 |
(3)若D为氯碱工业的重要产品,应为NaOH,能与NaOH连续反应的物质反应的转化关系为Al3+
| NaOH |
| NaOH |
Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)①若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,则C为NaHCO3,A、B、C的转化关系为
NaOH
| CO2 |
| CO2 |
②因为NaOH是强碱,在溶液中完全电离,而Na2CO3,NaHCO3是弱酸强碱盐,是在水的作用下而发生水解显碱性,
Na2CO3,NaHCO3水解的程度只是少部分,并且Na2CO3大于NaHCO3水解程度,以此判断水解程度大小;
③将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),以此判断离子浓度大小.
解答:解:(1)若D为用量最大、用途最广的金属单质为Fe,加热蒸干B的溶液没有得到B的盐,说明该盐对应的酸为挥发性酸,则B的化学式可能为FeCl3 或Fe(NO3)3,转化关系分别为:Cl2
FeCl3
FeCl2,HNO3
Fe(NO3)3
Fe(NO3)2,故答案为:FeCl3 或Fe(NO3)3;
(2)B和D为空气的主要成分,则为N2和O2,根据A→B→C的反应中都有D参加反应,则D应为O2,B为N2,转化关系为:
NH3
N2
→NO,则A为 NH3,电子式为 ,B为N2,结构式为N≡N,故答案为:
,B为N2,结构式为N≡N,故答案为: ;N≡N;
;N≡N;
(3)若D为氯碱工业的重要产品,应为NaOH,能与NaOH连续反应的物质反应的转化关系为Al3+
Al(OH)3
AlO2-,则反应(Ⅲ)的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)①若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,则C为NaHCO3,A、B、C的转化关系为NaOH
Na2CO3
NaHCO3,25℃时,pH均为10的NaOH、Na2CO3两溶液中,由水电离出的氢氧根离子浓度分别为:NaOH:c(OH-)=10-10mol/L,Na2CO3:c(OH-)=10-4mol/L,所以由水电离出的氢氧根离子浓度之比为10-6:1或1:106,故答案为:10-6:1或1:106;
②因为NaOH是强碱,在溶液中完全电离,而Na2CO3,NaHCO3是弱酸强碱盐,是在水的作用下而发生水解显碱性,Na2CO3,NaHCO3水解的程度只是少部分,并且Na2CO3大于NaHCO3水解程度,当PH相同时,NaOH浓度最小,NaHCO3浓度最大,故答案为:NaHCO3;
③将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),所以顺序为:c(Na+ )>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+ )>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
| Fe |
| Fe |
| Fe |
| Fe |
(2)B和D为空气的主要成分,则为N2和O2,根据A→B→C的反应中都有D参加反应,则D应为O2,B为N2,转化关系为:
NH3
| O2 |
| O2 |
 ,B为N2,结构式为N≡N,故答案为:
,B为N2,结构式为N≡N,故答案为: ;N≡N;
;N≡N;(3)若D为氯碱工业的重要产品,应为NaOH,能与NaOH连续反应的物质反应的转化关系为Al3+
| NaOH |
| NaOH |
Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)①若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,则C为NaHCO3,A、B、C的转化关系为NaOH
| CO2 |
| CO2 |
②因为NaOH是强碱,在溶液中完全电离,而Na2CO3,NaHCO3是弱酸强碱盐,是在水的作用下而发生水解显碱性,Na2CO3,NaHCO3水解的程度只是少部分,并且Na2CO3大于NaHCO3水解程度,当PH相同时,NaOH浓度最小,NaHCO3浓度最大,故答案为:NaHCO3;
③将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),所以顺序为:c(Na+ )>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+ )>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评:本题考查较为综合,涉及元素化合物的推断、浓度的计算和离子浓度的大小比较等问题,题目具有一定难度,做题时注意把握推断的思路和盐类的水解规律.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分反应中的水已略去). Fe(OH)3+3H+
Fe(OH)3+3H+