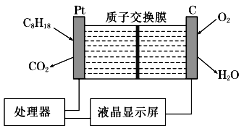
题目内容
【题目】下列说法正确的是( )
A. 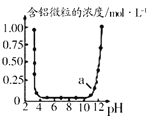 表示
表示![]() 与
与![]() 反应时含铝微粒浓度变化曲线,图中a点溶液中含大量
反应时含铝微粒浓度变化曲线,图中a点溶液中含大量![]()
B. 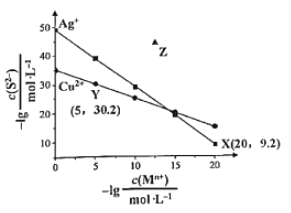 可知
可知![]() 平衡常数很大,反应趋于完全
平衡常数很大,反应趋于完全
C. 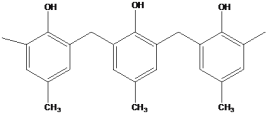 为一种高分子结构片断,可知该高分子的结构简式为
为一种高分子结构片断,可知该高分子的结构简式为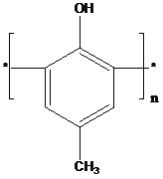
D.  反应①比反应②的速率慢,与相应正反应的活化无关
反应①比反应②的速率慢,与相应正反应的活化无关
【答案】B
【解析】
A.a点所示pH接近12,显强碱性,碱性环境中铝离子会先生成氢氧化铝沉淀,后转化为偏铝酸根,故a点溶液中存在的含铝微粒为偏铝酸根,故A错误;
B.图象X(20,9.2)c(Ag+)=10-20mol/L,c(S2-)=10-9.2mol/L,Ksp(Ag2S)=c2(Ag+)c(S2-)= (10-20mol/L)2×10-9.2mol/L=10-49.2,同理可知Ksp(CuS)=10-5×10-30.2=10-35.2,CuS(s)+2Ag+(aq)Ag2S(s)+Cu2+(aq)平衡常数K=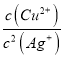 =
=![]() =
=![]() ==1014,反应趋于完全,故B正确;
==1014,反应趋于完全,故B正确;
C.该高分子化合物由对甲基苯酚与甲醛缩合生成,则高分子的结构简式为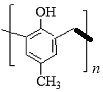 ,故C错误;
,故C错误;
D.根据图象可知,反应①中正反应的活化能较小,反应②中正反应的活化能较大,则反应①比反应②的速率快,故D错误;
故答案为:B。

【题目】室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=![]() mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
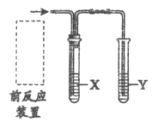
【题目】实验室用下图装置完成表中的四个实验,不能达到实验目的的是
实验装置 | 实验目的 | 试剂X | 试剂Y | |
| A. | 检验C2H5Br消去反应后的气体产物 | 水 | 酸性KMnO4溶液 |
B. | 检验C2H5OH消去反应后的气体产物 | NaOH溶液 | Br2的CCl4溶液 | |
C. | 比较醋酸、碳酸、苯酚酸性强弱 | NaOH溶液 | 苯酚钠溶液 | |
D. | 检验制取乙炔时的气体产物 | CuSO4溶液 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
【题目】现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)![]() 元素的电负性_____
元素的电负性_____![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 元素的电负性。
元素的电负性。
(3)![]() 基态原子中能量最高的电子,其电子云在空间有__________个方向。
基态原子中能量最高的电子,其电子云在空间有__________个方向。
(4)下列关于F原子的价层电子排布图正确的是___________。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(5)基态![]() 离子核外电子排布式为_____________。
离子核外电子排布式为_____________。
(6)元素铜与镍的第二电离能分别为:![]() ,
,![]() ,
,![]() 原因是_________。
原因是_________。