题目内容
【题目】处于同一周期的A,B,C,D四种短周期元素,其气态原子获得一个电子所放出的能量大小顺序为![]() 。则下列说法中,正确的是( )
。则下列说法中,正确的是( )
a.元素的非金属性依次增强
b.元素的电负性依次减小
c.元素的第一电离能依次增大
d.最高价氧化物对应水化物的酸性依次减弱
A.adB.bdC.acD.cd
【答案】B
【解析】
同周期元素气态原子获得一个电子所放出的能量A>B>C>D,说明非金属性A>B>C>D,同周期元素从左到右元素的金属性逐渐降低,则原子序数A>B>C>D,以此解答该题。
a.其气态原子获得一个电子所放出的能量大小顺序,A>B>C>D,非金属性A>B>C>D,故四种元素在周期表中从左到右依次为D、C、B、A,元素的非金属性依次增强,同周期元素A、B、C、D从左到右元素的金属性逐渐降低,故a错误;
b.其气态原子获得一个电子所放出的能量大小顺序,A>B>C>D ,原子对键合电子的吸引力就是电负性,元素的电负性依次减小,故b正确;
c.元素的第一电离能指的是气态电中性基态原子失去一个电子变成气态基态正离子需要的能量,四种元素在周期表中从左到右依次为D、C、B、A,则第一电离能呈现增大的趋势,由于第VA族的元素p轨道电子处于半充满状态,使其第一电离能反常,大于第VIA族元素,例如Si、P、S、Cl,第一电离能Cl>P>S>Si,故c错误;
d.四种元素在周期表中从左到右依次为D、C、B、A,则A、B、C、D的非金属性逐渐减弱,最高价氧化物对应水化物![]() 均存在
均存在![]() 的酸性依次减弱,故d正确;
的酸性依次减弱,故d正确;
故bd正确,答案选B。

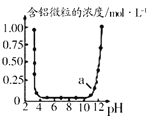
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/mol·L-1 | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)写出醋酸的电离方程式:___。
(2)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为___。
(3)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=__mol/L。
(4)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸 e.加入少量镁粉 f.加入少量0.10mol·L-1的NaOH溶液
(5)室温时醋酸的电离常数Ka=1.8×10-5,则CH3COO-的水解常数Kh=___。
【题目】下表列出了某短周期元素R的各级电离能数据![]() 用
用![]() 、
、![]() 表示,单位为
表示,单位为![]() 。下列关于元素R的判断中一定正确的是
。下列关于元素R的判断中一定正确的是 ![]()
![]()
|
|
|
|
|
|
|
R | 740 | 1500 | 7700 | 10500 | 13600 |
|
a.![]() 的最高正价为
的最高正价为![]() 价
价
b.![]() 元素位于元素周期表中第ⅡA族
元素位于元素周期表中第ⅡA族
c.![]() 元素第一电离能大于同周期相邻元素
元素第一电离能大于同周期相邻元素
d.![]() 元素的原子最外层共有4个电子
元素的原子最外层共有4个电子
e.![]() 元素基态原子的电子排布式为
元素基态原子的电子排布式为![]()
A.acB.bcC.bcdD.bce