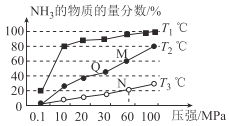
题目内容
【题目】微量元素硼对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。
![]() 基态硼原子的价电子轨道表达式是______。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
基态硼原子的价电子轨道表达式是______。与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为______。
![]() 晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的______。
晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的______。
![]() 的简单氢化物
的简单氢化物![]() 不能游离存在,常倾向于形成较稳定的
不能游离存在,常倾向于形成较稳定的![]() 或与其他分子结合。
或与其他分子结合。
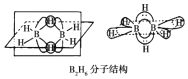
![]() 分子结构如图,则B原子的杂化方式为______。
分子结构如图,则B原子的杂化方式为______。
![]() 氨硼烷
氨硼烷![]() 被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______,写出一种与氨硼烷互为等电子体的分子______
被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是______,写出一种与氨硼烷互为等电子体的分子______![]() 填化学式
填化学式![]() 。
。
![]() 以硼酸
以硼酸![]() 为原料可制得硼氢化钠
为原料可制得硼氢化钠![]() ,它是有机合成中的重要还原剂。
,它是有机合成中的重要还原剂。![]() 的立体构
的立体构
型为______。
【答案】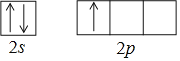
![]() 自范性
自范性 ![]() 杂化 N
杂化 N ![]() 正四面体
正四面体
【解析】
![]() 处于周期表中第2周期第ⅢA族,基态硼原子的价电子3个,价电子排布式为
处于周期表中第2周期第ⅢA族,基态硼原子的价电子3个,价电子排布式为![]() ,同周期元素的第一电离依次增大,其中第ⅡA族和第ⅤA族的因素的第一电离能比相邻元素的第一电离能大;
,同周期元素的第一电离依次增大,其中第ⅡA族和第ⅤA族的因素的第一电离能比相邻元素的第一电离能大;
![]() 晶体的特征性质为自范性、对称性、各向异性;
晶体的特征性质为自范性、对称性、各向异性;
![]() 分子的结构可知,
分子的结构可知,![]() 分子中有
分子中有![]() 共价键,每个B原子周围有4个共价键,据此判断杂化方式;
共价键,每个B原子周围有4个共价键,据此判断杂化方式;
![]() 原子有空轨道,
原子有空轨道,![]() 中N原子有1对孤电子对,与氨硼烷互为等电子体的分子,可以用2个C原子代替B、N原子;
中N原子有1对孤电子对,与氨硼烷互为等电子体的分子,可以用2个C原子代替B、N原子;
![]() 为离子化合物,含离子键、共价键,
为离子化合物,含离子键、共价键,![]() 中含四个共价键,B原子是sp3杂化;
中含四个共价键,B原子是sp3杂化;
![]() 处于周期表中第二周期第ⅢA族,价电子排布式为
处于周期表中第二周期第ⅢA族,价电子排布式为![]() ,则其价电子轨道表示式为:
,则其价电子轨道表示式为:![]() ,
,
同周期主族元素随着原子序数增大,第一电离能呈增大的趋势,但第ⅡA族和第ⅤA族元素反常,与硼处于同周期且相邻的两种元素和硼的第一电离能由大到小的顺序为:![]() ,
,
故答案为:![]() ;
; ![]() ;
;
![]() 能自发地呈现多面体外形,这种性质称为晶体的自范性,
能自发地呈现多面体外形,这种性质称为晶体的自范性,
故答案为:自范性;
![]() 分子的结构可知,
分子的结构可知,![]() 分子中有
分子中有![]() 共价键,
共价键,![]() 分子中有2种共价键,每个B原子周围有4个共价键,所以B原子的杂化方式为
分子中有2种共价键,每个B原子周围有4个共价键,所以B原子的杂化方式为![]() ,
,
故答案为:![]() 杂化;
杂化;
![]() 原子有空轨道,
原子有空轨道,![]() 中N原子有1对孤电子对,N原子提供孤电子对与B原子形成配位键,与氨硼烷互为等电子体的分子,可以用2个C原子代替B、N原子,与氨硼烷等电子体一种分子为:
中N原子有1对孤电子对,N原子提供孤电子对与B原子形成配位键,与氨硼烷互为等电子体的分子,可以用2个C原子代替B、N原子,与氨硼烷等电子体一种分子为:![]() ,
,
故答案为:N; ![]() ;
;
![]() 为离子化合物,含离子键、共价键,
为离子化合物,含离子键、共价键,![]() 中含四个共价键,B原子是sp3杂化,其电子式为
中含四个共价键,B原子是sp3杂化,其电子式为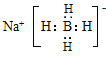 ,其中
,其中![]() 立体构型为正四面体,
立体构型为正四面体,
故答案为:正四面体。

【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q kJ |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率