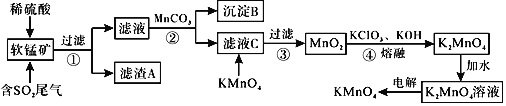
题目内容
【题目】氮的氧化物NO3是常见的大气污染物,化学上采用NH3处理NxOy不仅可以消除污染,还可作为工业生产的能量来源。
(1)已知:I.2NO(g)=N2(g)+O2(g) △H=-177kJ/mol
II.4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H=-1253.4kJ/mol
则用NH3处理NO生成氮气和气态水的热化学方程式为__________________。
(2)已知:N2(g)+3H2(g) ![]() 2NH3(g)△H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。
2NH3(g)△H<0。不同温度下,向三个一样的容器中投入相同的反应物进行反应,测得不同压强下平衡混合物中NH3的物质的量分数如图所示。

①M点的v正_________Q点的v正(填“>”“<”或“=”),原因是________________________。
②维持10MPa、T3℃的条件不变,要提高H2的转化率,可以采取的措施是__________________(任写一条)。
③图中三条曲线对应的温度T1、T2、T3由高到低的顺序为__________________。
④恒温恒容条件下,能说明反应N2(g)+3H2(g) ![]() 2NH3(g)达到平衡状态的是_________(填选项字母)
2NH3(g)达到平衡状态的是_________(填选项字母)
A.c2(NH3)/[c(N2 )c3(H2)]保持不变
B.3mol H-H键断裂的同时,有2mol N-H键断裂
C.2v(N2)=v(NH3)
D.反应器中的压强不再发生变化
⑤T3温度下,将1molN2和3molH2充入2L的密闭容器中,维持压强为60MPa不变,达到N点的平衡状态,反应的浓度平衡常数Kc=_____________ (mol/L)-2(用最简分数表示),M点的平衡常数比N点的平衡常数_________(填“大”“小”或“相等”)。
【答案】4NH3(g)+ 6NO(g)===5N2(g)+6H2O(g) △H=-1784.4kJ/mol > 其他条件相同,M点压强大,反应速率快 增大氮气的浓度,也可以及时分离出氨气 T3>T2>T1 AD ![]() 大
大
【解析】
(1) I×3+ II得到热方程式为: 4NH3(g)+ 6NO(g)===5N2(g)+6H2O(g) △H=-1784.4kJ/mol;
故答案为:4NH3(g)+ 6NO(g)===5N2(g)+6H2O(g) △H=-1784.4kJ/mol;
(2) ①其他条件相同,M点的压强大于Q点,所以M点的速率大于Q点;
故答案为:>,其他条件相同,M点压强大,反应速率快;
②维持10MPa、T3℃的条件不变,要提高H2的转化率,可增大氮气的浓度,也可以及时分离出氨气;
故答案为:增大氮气的浓度,也可以及时分离出氨气;
③该反应是放热反应,温度升高向吸热方向移动,所以温度越高,氨气的物质的量分数越低,故T3>T2>T1;
故答案为:T3>T2>T1;
④A.化学平衡时,各组分的浓度不再改变,故A达到 ;
B. 化学平衡时3mol H-H键断裂的同时,应该有6mol N-H键断裂,故B不是;
C.化学平衡时,需正反应速率等于逆反应速率,故C不是;
D. N2(g)+3H2(g) ![]() 2NH3(g)反应达到化学平衡时,压强不再改变,即各组分浓度不再改变,故D达到;
2NH3(g)反应达到化学平衡时,压强不再改变,即各组分浓度不再改变,故D达到;
故选AD;
⑤由于保持压强不变,所以达到平衡时,体积减小,根据反应方程式N2 + 3H2 = 2NH3 ,设达到平衡时,N2的变化量为xmol,
即 N2 + 3H2 = 2NH3
初始状态 1mol 3mol 0
平衡时变化量 xmol 3xmol 2xmol
平衡时状态 (1-x)mol (3-3x)mol 2xmol 根据图像可知,其中NH3的物质的量分数为20%,
可得到关系:![]() ×100%=20%,得到x=
×100%=20%,得到x=![]() mol,由于压强不变,即体系体积减小,根据物质的量之比等于体积之比,可得到平衡时体系的体积为:
mol,由于压强不变,即体系体积减小,根据物质的量之比等于体积之比,可得到平衡时体系的体积为:![]() =
=![]() ,a=
,a=![]() L,Kc=
L,Kc=![]() =
=![]() ;由于T2<T3,正反应方向是放热反应,温度升高,平衡向逆反应方向移动,K减小,故M点的平衡常数大于N点的平衡常数;
;由于T2<T3,正反应方向是放热反应,温度升高,平衡向逆反应方向移动,K减小,故M点的平衡常数大于N点的平衡常数;
故答案为:![]() ,大;
,大;

【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是

①中试剂 | ①中现象 | 解释 | |
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
D | 酸性Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成BaSO3沉淀 |
A. A B. B C. C D. D