题目内容
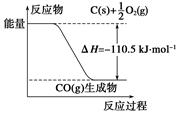
反应2C+O2===2CO的能量变化如下图所示。下列说法正确的是( )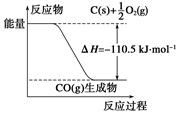
| A.12 g C(s)与一定量O2(g)反应生成14 g CO(g)放出的热量为110.5 kJ |
| B.该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ |
| C.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ |
| D.该反应的反应热等于CO分子中化学键形成时所释放的总能量与O2分子中化学键断裂时所吸收的总能量的差 |
C
解析试题分析:根据图示:A选项错误,12 g C(s)与一定量O2(g)反应生成28 g CO(g)放出的热量为110.5 kJ;B选项错误,ΔH的单位一般为kJ·mol-1(kJ/mol),该反应的热化学方程式是2C(s)+O2(g)===2CO(g) ΔH=-221 kJ·mol-1;C选项正确,2 mol C(s)与O2(g)反应生成CO(g)放出的热量为221 kJ,由于CO(g)与O2(g)反应生成CO2 (g)放热,因此2 mol C(s)与足量O2 (g)反应生成CO2(g)放出的热量大于221 kJ,D选项错误,该反应的反应热等于CO分子中化学键形成时所释放的总能量与C、O2分子中化学键断裂时所吸收的总能量的差。故选C。
考点:化学反应与能量变化
点评:注意热化学方程式的书写正误判断以及盖斯定律的运用,属于常考知识点。

练习册系列答案
相关题目
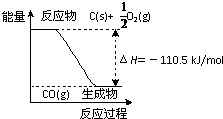 反应2C+O2=2CO 的能量变化如图所示.下列说法正确的是( )
反应2C+O2=2CO 的能量变化如图所示.下列说法正确的是( )