题目内容
11.A、B、C、D、E是五种短周期主族元素,它们的原子序数依次增大,其中A的最高正价与最低负价的代数和等于0,B、E是同一主族元素,C原子半径大于所在同周期中其它主族元素的原子半径,D元素的最外层电子数等于其电子层数,E元素的最外层电子是次外层电子数的0.75倍,则下列说法正确的是( )| A. | B、C、D形成的简单离子,半径最小的是B | |
| B. | E形成最简单氢化物稳定性比B强 | |
| C. | A、C、D形成的最高价氧化物的水化物两两间可相互反应 | |
| D. | A、B形成的化合物与B、E形成的化合物化学键类型相同 |
分析 A、B、C、D、E是五种短周期主族元素,它们的原子序数依次增大,B、E是同一主族元素,则B处于第二周期、E处于第三周期,E元素的最外层电子是次外层电子数的0.75倍,最外层电子数为8×0.75=6,故E为S元素,则B为O元素;C原子半径大于所在同周期中其它主族元素的原子半径,则C为Na;D元素的最外层电子数等于其电子层数,则D为Al;其中A的最高正价与最低负价的代数和等于0,则A为C元素(一般不考虑H元素),据此解答.
解答 解:A、B、C、D、E是五种短周期主族元素,它们的原子序数依次增大,B、E是同一主族元素,则B处于第二周期、E处于第三周期,E元素的最外层电子是次外层电子数的0.75倍,最外层电子数为8×0.75=6,故E为S元素,则B为O元素;C原子半径大于所在同周期中其它主族元素的原子半径,则C为Na;D元素的最外层电子数等于其电子层数,则D为Al;其中A的最高正价与最低负价的代数和等于0,则A为C元素(一般不考虑H元素).
A.B、C、D形成的简单离子分别为O2-、Na+、Al3+,离子电子层结构相同,核电荷数越大离子半径越小,故O2-离子半径最大,Al3+离子半径最小,故A错误;
B.非金属性B(O)>E(S),故E形成最简单氢化物稳定性比B弱,故B错误;
C.A、C、D形成的最高价氧化物的水化物分别为碳酸、氢氧化钠、氢氧化铝,碳酸与氢氧化铝不能反应,故C错误;
D.A、B形成的化合物有CO、CO2,B、E形成的化合物SO2,SO3,均只含有共价键,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意H元素最高正价与最低负价的代数和也等于0,中学一般不考虑.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
16.下列说法正确的是( )
| A. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| B. | 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 | |
| C. | 在同一条件下,不同物质有不同的焓值,其体系的混乱程度越大,焓值越大 | |
| D. | AgCl在浓度相同的MgCl2溶液和KCl溶液中的溶解度相同 |
19.下列互为同分异构体的一组是( )
| A. | 乙醇和乙酸 | B. | 金刚石和石墨 | ||
| C. | ${\;}_{8}^{16}$O和${\;}_{8}^{17}$O | D. | CH3CH2CH2CH3和 |
6.下列各组混合物中,按照溶解、过滤、蒸发的操作顺序能将它们分离的是( )
| A. | 氧化铜和碳粉 | B. | 硝酸钾和氯化钠 | C. | 水和酒精 | D. | 碳酸钠和碳酸钡 |
16.下列物质间不能发生反应的是( )
| A. | H2SO4和Ba(OH)2 | B. | CO2和NaOH | C. | CaCO3和HCl | D. | Na2CO3和K2SO4 |
3.(1)将充满NO2气体的密闭烧瓶浸入冰水中,烧瓶内气体颜色变浅(填“变深”、“不变”或“变浅”),请用平衡移动原理说明变化原因2NO2?N2O4△H<0,降低温度,平衡向放热方向即正反应方向移动,导致二氧化氮气体的浓度降低;
(2)在80℃时,将0.40mol N2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如表数据:
①计算a=0.28mol,此温度时该反应的平衡常数K=1.8mol/L;
②改变条件使反应重新达到平衡,能使$\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$值变小的措施有(填序号)A.
A.增大N2O4的起始浓度 B.升高温度 C.使用高效催化剂 D.向混合气体中通入稀有气体.
(2)在80℃时,将0.40mol N2O4气体充入2L已经抽空的固定容积的密闭容器中发生反应,隔一段时间对该容器内的物质进行分析,得到如表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4)/mol | 0.40 | a | 0.20 | c | d | e |
| n(NO2)/mol | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
②改变条件使反应重新达到平衡,能使$\frac{c(N{O}_{2})}{c({N}_{2}{O}_{4})}$值变小的措施有(填序号)A.
A.增大N2O4的起始浓度 B.升高温度 C.使用高效催化剂 D.向混合气体中通入稀有气体.
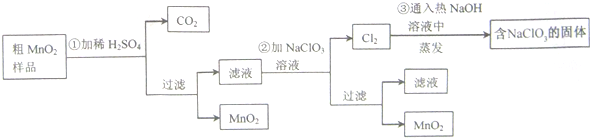
 ,氧化剂是氯酸钾,还原产物是Cl2.
,氧化剂是氯酸钾,还原产物是Cl2.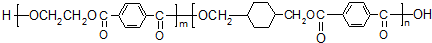
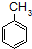 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$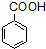
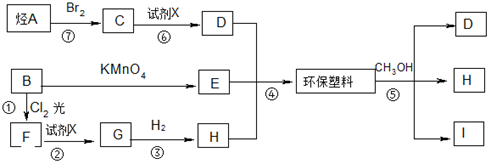
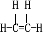 ;
;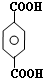 ;B的名称:对二甲苯,试剂X为NaOH水溶液.
;B的名称:对二甲苯,试剂X为NaOH水溶液.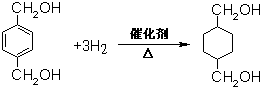 .
.