题目内容
4.在水溶液中,下列电离方程式正确的是( )| A. | CH3COOH═CH3COO-+H+ | B. | NaHSO4═Na++HSO4- | ||
| C. | HCO3-═H++CO32- | D. | HPO4-?H++PO43- |
分析 A.醋酸为弱电解质,部分电离用可逆号;
B.硫酸氢钠为强电解质,在水溶液中完全电离生成钠离子、氢离子和硫酸根离子;
C.碳酸氢根离子为多元弱酸的酸式根离子,部分电离,用可逆号;
D.磷酸氢根离子为多元弱酸的酸式根离子,部分电离,用可逆号;
解答 解:A.醋酸为弱电解质,电离方程式:CH3COOH CH3COO-+H+,故A错误;
B.硫酸氢钠为强电解质,在水溶液中完全电离生成钠离子、氢离子和硫酸根离子,电离方程式:NaHSO4═Na++H++SO42-.故B错误;
C.碳酸氢根离子为多元弱酸的酸式根离子,部分电离,用可逆号,电离方程式:HCO3-H++CO32-,故C错误;
D.磷酸氢根离子为多元弱酸的酸式根离子,部分电离,用可逆号,电离方程式:HPO4-?H++PO43-,故D正确;
故选:D.
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱及电离方式是解题关键,注意多元弱酸根离子部分电离,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.在一定条件下CO(g)和H2(g)发生反应:CO(g)+2H2(g)?CH3OH(g).在容积固定且均为1L的a、b、c三个密闭容器中分别充入1mol CO(g)和2mol H2(g),三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到5min时CH3OH(g)的浓度如图所示.下列说法正确的是( )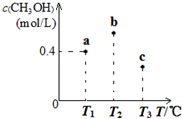

| A. | a容器中,0~5min内平均反应速率ν(H2)=0.04mol/(L.min) | |
| B. | 反应均进行到5min时,三个容器中一定达到化学平衡状态的是b | |
| C. | 当三个容器内的反应都达到化学平衡时,CO转化率最大的是a | |
| D. | 保持温度和容积不变,若开始时向b容器中充入0.6mol CO(g)、1.2mol H2(g)和0.4mol CH3OH(g),则反应开始时ν正(H2)<ν(逆) |
12.下列关于氯气或氯水的叙述不正确的是( )
| A. | 氯气能使润湿的淀粉碘化钾试纸变蓝 | |
| B. | 新制的氯水呈黄绿色是因为在溶液中溶有氯气分子 | |
| C. | 与久置氯水不同,在新制氯水中加入硝酸银溶液后无白色沉淀 | |
| D. | 氯水久置后,会使溶液酸性增强 |
19.下列各组物质相互反应时,改变反应的条件或者反应物的物质的量之比,生成的产物不变的是( )
| A. | Na与氧气 | B. | 澄清石灰水与二氧化碳 | ||
| C. | 碳与氧气 | D. | 过氧化钠和水 |
9.在某温度时,pH=3的某水溶液中c(OH-)=10-9 mol•L-1,现有该温度下的四份溶液:①pH=2的CH3COOH;②0.01mol•L-1的HCl;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A. | ①中水的电离程度最小,③中水的电离程度最大 | |
| B. | 若将②与④按照10:1的体积比混合,混合溶液的pH<7 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:③>④>②>① | |
| D. | 将四份溶液稀释相同倍数后,溶液的pH:④>③>①>② |
16.下列实验基本操作或实验注意事项中,主要是基于实验安全考虑的是( )
| A. | 可燃性气体的验纯 | B. | 滴管不能交叉使用 | ||
| C. | 容量瓶在使用前进行检漏 | D. | 实验剩余的药品不能放回原试剂瓶 |
13.同物质的量浓度的KCl、CaCl2、AlCl3三种溶液的体积比为3:2:1,这三种溶液中Cl-的物质的量之比是( )
| A. | 3:2:1 | B. | 1:2:3 | C. | 3:4:3 | D. | 2:3:1 |
14.下列有关物质性质的描述中,正确的是( )
| A. | Na2O的水溶液能导电,不能说明Na2O是电解质 | |
| B. | CO、NO、SO2都是大气污染物,在空气中都能稳定存在 | |
| C. | 石英和玛瑙的主要成分均为二氧化硅,其分子式为SiO2 | |
| D. | 酸性氧化物大多数是非金属氧化物,因此不能与酸溶液发生反应 |
