题目内容
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等. 实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂.
回答下列问题:
(1)水合肼的制备有关反应原理为: NaClO+2NH3 = N2H4·H2O+NaCl
①用下图装置制取水合肼,其连接顺序为_________________(按气流方向,用小写字母表示).
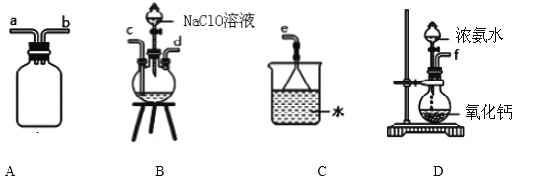
②开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加 NaClO溶
液.滴加 NaClO溶液时不能过快的理由_________________________________________。
(2)碘化钠的制备
i.向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g.
③步骤i反应完全的现象是______________________。
④步骤ii中IO3-参与反应的离子方程式为________________________________________。
⑤步骤iii “将溶液与活性炭分离”的方法是______________________。
⑥本次实验产率为_________,实验发现,水合肼实际用量比理论值偏高,可能的原因是_____________。
⑦某同学检验产品NaI中是否混有NaIO3杂质. 取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝. 得出NaI中含有NaIO3杂质. 请评价该实验结论的合理性:_________(填写“合理”或“不合理”),_________(若认为合理写出离子方程式,若认为不合理说明理由).
【答案】f a b c d e(ab顺序可互换) 过快滴加NaClO溶液,过量的NaClO溶液氧化水合肼,降低产率 无固体残留且溶液呈无色(答出溶液呈无色即给分) 2IO3-+3N2H4·H2O=3N2↑+2I-+9H2O 趁热过滤或过滤 80% 水合胼能与水中的溶解氧反应 不合理 可能是I- 在酸性环境中被O2氧化成I2而使淀粉变蓝
【解析】
(1)水合肼的制备原理为:NaClO+2NH3═N2H4H2O+NaCl,利用装置D制备氨气,装置A为安全瓶,防止溶液倒吸,气体通入装置B滴入次氯酸钠溶液发生反应生成水合肼,剩余氨气需要用装置C吸收;(2)加入氢氧化钠,碘和氢氧化钠发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,加入水合肼得到氮气与NaI,得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI;⑥由碘单质计算生成的NaI与NaIO3,再由NaIO3计算与N2H4H2O反应所得的NaI,由此计算得到理论生成的NaI,再计算产率可得;⑦NaIO3能够氧化碘化钾,空气中氧气也能够氧化碘离子生成碘单质。据此分析解答。
(1)①水合肼的制备原理为:NaClO+2NH3═N2H4H2O+NaCl,利用装置D制备氨气,通过装置A安全瓶,防止溶液倒吸,气体通入装置B滴入次氯酸钠溶液发生反应生成水合肼,剩余氨气需要用装置C吸收,倒扣在水面的漏斗可以防止倒吸,按气流方向其连接顺序为:fabcde,故答案为:fabcde;
②开始实验时,先向氧化钙中滴加浓氨水,生成氨气一段时间后再向B的三口烧瓶中滴加 NaClO溶液反应生成水合肼,水合肼有还原性,滴加NaClO溶液时不能过快的理由:过快滴加NaClO溶液,过量的NaClO溶液氧化水和肼,降低产率,故答案为:过快滴加NaClO溶液,过量的NaClO溶液氧化水和肼,降低产率;
(2)③步骤ii中碘单质生成NaI、NaIO3,反应完全时现象为无固体残留且溶液接近无色,故答案为:无固体残留且溶液接近无色;
④步骤iiiN2H4H2O还原NalO3的化学方程式为:3N2H4H2O+2NaIO3=2NaI+3N2↑+9H2O,离子方程式为:3N2H4H2O+2IO3-=2I-+3N2↑+9H2O,故答案为:3N2H4H2O+2IO3-=2I-+3N2↑+9H2O;
⑤活性炭具有吸附性,能脱色,通过趁热过滤将活性炭与碘化钠溶液分离,故答案为:趁热过滤;
⑥8.2gNaOH与25.4g单质碘反应,氢氧化钠过量,碘单质反应完全,碘和氢氧化钠发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,则生成的NaI的质量为:![]() ×5×150g/mol=25g,生成的NaIO3与N2H4H2O反应所得的NaI,反应为3N2H4H2O+2NaIO3=2NaI+3N2↑+9H2O,则6I2~2NaIO3~2NaI,该步生成的NaI质量为:
×5×150g/mol=25g,生成的NaIO3与N2H4H2O反应所得的NaI,反应为3N2H4H2O+2NaIO3=2NaI+3N2↑+9H2O,则6I2~2NaIO3~2NaI,该步生成的NaI质量为:![]() ×2×150g/mol=5g,故理论上生成的NaI为25g+5g=30g,实验成品率为
×2×150g/mol=5g,故理论上生成的NaI为25g+5g=30g,实验成品率为![]() ×100%=80%,实验发现,水合肼实际用量比理论值偏高是因为水合肼能与水中的溶解氧反应,故答案为:80%;水合肼能与水中的溶解氧反应;
×100%=80%,实验发现,水合肼实际用量比理论值偏高是因为水合肼能与水中的溶解氧反应,故答案为:80%;水合肼能与水中的溶解氧反应;
⑦取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝,说明生成碘单质,可能是NaIO3氧化碘化钾反应生成,也可能是空气中氧气氧化碘离子生成碘单质,不能得出NaI中含有NaIO3杂质,故答案为:不合理;可能是I-在酸性环境中被氧气氧化成I2而使淀粉变蓝。

【题目】下列有关实验的选项正确的是
|
|
|
|
A.配制 0.10 mol·L-1NaOH溶液 | B.苯萃取碘水中I2,分出水层后的操作 | C.除去CO中的CO2 | D.记录滴定终点读数为12.20mL |
A. A B. B C. C D. D