题目内容
向盛有乙醇的烧杯中投入一小块金属钠,下列对该实验现象的描述正确的是 ( )
| A.钠块沉在乙醇液面的下面 | B.钠块熔化成小球 |
| C.钠块在乙醇的液面上游动 | D.乙醇溶液变红 |
A
钠属于活泼的金属,能置换出醇中羟基上的氢原子生成氢气。由于醇中羟基上的氢原子不如水中的氢原子活泼,所以反应很平缓。又因为的密度大于乙醇的,所以选项A是正确的。答案选A。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
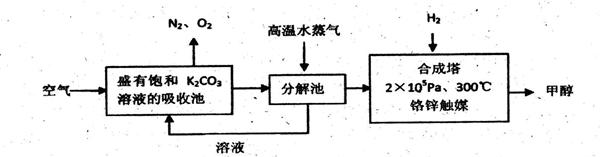
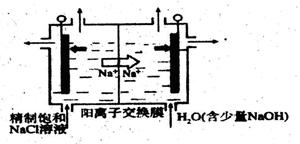
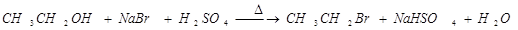 ,
,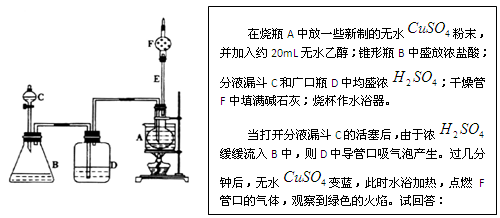
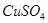 变蓝的原因是________________________。
变蓝的原因是________________________。