题目内容
19.相同物质的量的CO2和O2,其分子数目之比为1:1,原子数目之比为3:2,氧原子数目之比为1:1,体积之比为(标准状况下)1:1,质量之比为11:8?分析 根据N=nNA可知,相同物质的量的CO2和O2,其分子数目之比为1:1,结合分子式中含有原子数目、O原子数目之比,根据V=nVm计算二者体积之比,再根据m=nM计算二者质量之比.
解答 解:根据N=nNA可知,相同物质的量的CO2和O2,其分子数目之比为1:1,每个CO2分子含有3个原子、2个O原子,每个O2分子含有2个原子、2个O原子,则含有原子数目之比为3:2,含有氧原子数目之比为1:1,根据V=nVm可知,二者体积之比为1:1,根据m=nM控制在,二者质量之比为44g/mol:32g/mol=11:8,
故答案为:1:1;3:2;1:1;1:1;11:8.
点评 本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
9.在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用.下图是生产亚氯酸钠的工艺流程图:
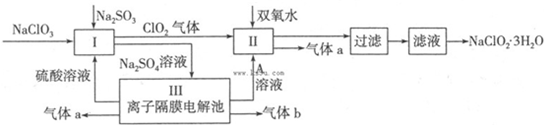
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4×10-28
(1)反应I中发生反应的离子方程式为SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是bdc(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为pH(Na2S)>pH(NaHCO3)>pH(NaF)>pH(NaClO2) (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为:后者大(填“前者大”“相等”或“后者大”).
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时体系中的S2-的浓度为6.3×10-13mol/L.
(4)Ⅲ装置中生成气体a的电极反应式2H2O-4e-=O2↑+4H+,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为0.2mol.

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4×10-28
(1)反应I中发生反应的离子方程式为SO32-+2ClO3-+2H+=2C1O2+SO42-+H2O.
(2)从滤液中得到NaClO2•3H2O晶体的所需操作依次是bdc(填写序号).
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2.下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 | HClO2 | HF | H2CO3 | H2S |
| Ka/mol•L-1 | 1×10-2 | 6.3×10-4 | K1=4.30×10-7 K2=5.60×10-11 | K1=9.1×10-8 K2=l.1×10-12 |
②Na2S是常用的沉淀剂.某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是CuS;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol•L-1)此时体系中的S2-的浓度为6.3×10-13mol/L.
(4)Ⅲ装置中生成气体a的电极反应式2H2O-4e-=O2↑+4H+,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为0.2mol.
14.下列各组离子能在同一溶液中大量共存的是( )
| A. | H+、Fe2+、Cl-、NO3- | B. | Na+、NH4+、HCO3-、SO42- | ||
| C. | NH4+、Ca2+、I-、SO42- | D. | Fe3+、K+、SCN-、Cl- |
11.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下22.4LNO2中分子数约为NA个 | |
| B. | 常温下,18g${\;}_{\;}^{18}$O2中含有个NA氧原子 | |
| C. | 31g白磷中含的共价键数为3NA | |
| D. | 25℃时pH=13的NaOH溶液中含有0.1NAOH- |
8.下列4组原子序数的元素,彼此间能形成共价键的是( )
| A. | 8和11 | B. | 8和13 | C. | 6和8 | D. | 12和9 |
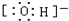 B
B E
E
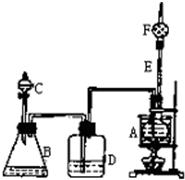 如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:
如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答: