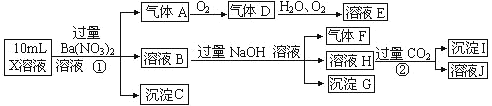
题目内容
【题目】Ⅰ、Cu2O 广泛应用于太阳能电池领域。以 CuSO4、NaOH 和抗坏血酸为原料,可制备 Cu2O。
(1)Cu2+基态核外电子排布式为________。
(2)SO4 2﹣的空间构型为_________(用文字描述),Cu2+与 OH-反应能生成[Cu(OH)4 ]2-, [Cu(OH)4]2-中的配位原子为_______(填元素符号)。
(3)抗坏血酸的分子结构如图 1 所示,分子中碳原子的轨道杂化类型为________;推测抗坏血酸在水中的溶解性:_______(填“难溶于水”或“易溶于水”)。
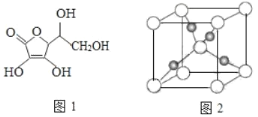
(4)一个 Cu2O 晶胞(如图 2)中,Cu 原子的数目为_________。
Ⅱ、磷酸亚铁锂(LiFePO4)可用作锂离子电池正极材料,具有热稳定性好、循环性能优良、安全性高等特点,文献报道可采用 FeCl3、NH4H2PO4、LiCl 和苯胺等作为原料制备。回答下列问题:
(5)在周期表中,与 Li 的化学性质最相似的邻族元素是___,该元素基态原子核外 M层电子的自旋状态_______(填“相同”或“相反”)。
(6)苯胺(![]() )的晶体类型是_________。苯胺与甲苯(
)的晶体类型是_________。苯胺与甲苯( ![]() )的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
)的相对分子质量相近,但苯胺的熔点(-5.9℃)、沸点(184.4℃)分别高于甲苯的熔点(-95.0℃)、沸点(110.6℃),原因是________。
【答案】1s22s22p63s23p63d9或[Ar]3d9 正四面体形 O sp3、sp2 易溶于水 4 Mg 相反 分子晶体 苯胺中存在电负性较强的N所以可以形成氢键,因此比甲苯的熔沸点高。
【解析】
(1)Cu原子失去4s能级上1个电子、3d能级上1个电子生成铜离子,据此书写该基态离子核外电子排布式;
(2)SO42-中S原子价层电子对个数![]() 且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型;该配离子中Cu2+提供空轨道、O原子提供孤电子对形成配位键;
且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型;该配离子中Cu2+提供空轨道、O原子提供孤电子对形成配位键;
(3)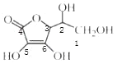 中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型;抗坏血酸中羟基属于亲水基,增大其水解性;
中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型;抗坏血酸中羟基属于亲水基,增大其水解性;
(4)该晶胞中白色球个数![]() 、黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子;
、黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子;
(5)根据元素周期表和对角线原则可知与锂化学性质相似的是镁,镁的M层电子数是2,占据s轨道,s轨道最多容纳2个电子,所以自旋方向相反;
(6)大多数有机物都是分子晶体,除了一部分有机酸盐和有机碱盐是离子晶体。苯胺比甲苯的熔沸点都高,同一种晶体类型熔沸点不同首先要考虑的就是是否有氢键,苯胺中存在电负性较强的N所以可以形成氢键,因此比甲苯的熔沸点高。
(1)Cu原子失去4s能级上1个电子、3d能级上1个电子生成铜离子,该基态离子核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9;
(2)SO42中S原子价层电子对个数![]() 且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型为正四面体形;该配离子中Cu2+提供空轨道、O原子提供孤电子对形成配位键,所以配原子为O;
且不含孤电子对,根据价层电子对互斥理论判断该微粒空间构型为正四面体形;该配离子中Cu2+提供空轨道、O原子提供孤电子对形成配位键,所以配原子为O;
(3)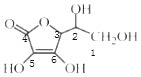 中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;抗坏血酸中羟基属于亲水基,增大其水解性,所以抗坏血酸易溶于水;
中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;抗坏血酸中羟基属于亲水基,增大其水解性,所以抗坏血酸易溶于水;
(4)该晶胞中白色球个数![]() 、黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子,则该晶胞中Cu原子数目为4;
、黑色球个数为4,则白色球和黑色球个数之比=2:4=1:2,根据其化学式知,白色球表示O原子、黑色球表示Cu原子,则该晶胞中Cu原子数目为4;
(5)根据元素周期表和对角线原则可知与锂化学性质相似的是镁,镁的M层电子数是2,占据s轨道,s轨道最多容纳2个电子,所以自旋方向相反;
(6)大多数有机物都是分子晶体,除了一部分有机酸盐和有机碱盐是离子晶体。苯胺比甲苯的熔沸点都高,同一种晶体类型熔沸点不同首先要考虑的就是是否有氢键,苯胺中存在电负性较强的N所以可以形成氢键,因此比甲苯的熔沸点高。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】结合元素周期律,结合下列事实推测不合理的是()
事实 | 推测 | |
A | IVA族 | 同族 |
B | HI在230℃时分解,HCl在1500℃时分解 | HF分解温度大于1500℃ |
C | H3PO4是中强酸,H2SO4是强酸 | HClO4是强酸 |
D | Na、Al通常用电解法冶炼 | Mg可用电解法冶炼 |
A.AB.BC.CD.D