(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N
2(g)+3H
2(g)

2NH
3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
容器
| 甲
| 乙
| 丙
|
反应物投入量
| 3molH2、2molN2
| 6molH2、4molN2
| 2mol NH3
|
达到平衡的时间/min
|
| 6
| 8
|
平衡时 N2的体积密度
| C1
| 1.5
|
|
混合气体密度/g·L-1
| 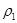
| 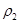
|
|
平衡常数/ L2·mol-2
| K甲
| K乙
| K丙
|
(1)下列各项能说明该反应已到达平衡状态的是
(填写序号字母)
a.容器内H
2、N
2、NH
3的浓度只比为1:3:2 b.容器内压强保持不变
c.
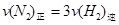
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为
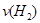
=
(3)在该温度下甲容器中反应的平衡常数K
(用含C
1的代数式表示)
(4)分析上表数据,下列关系正确的是
(填序号):
a.
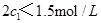
b.氮气的转化率:
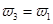
c.
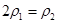
d.
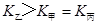
(5)另据报道,常温、常压下,N
2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH
3和O
2。已知:H
2的燃烧热△H=-286KJ/mol,则由次原理制NH
3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到
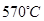
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N
2不断地通入
极,该电极反应式为
。






 CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应: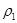
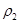
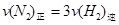 d.混合气体的密度保持不变
d.混合气体的密度保持不变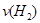 =
= 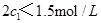 b.氮气的转化率:
b.氮气的转化率: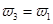 c.
c. 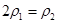 d.
d.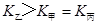
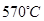 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。 O2(g)=H2O(g)
O2(g)=H2O(g)  kJ·mol-1,② C(s)+
kJ·mol-1,② C(s)+ kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)
kJ·mol-1。由此可知焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)=CO(g)+H2(g)  ,则
,则