题目内容
17.某酸溶液中c(H+)=0.1mol/L,则该酸溶液的物质的量浓度( )| A. | 一定等于0.1mol/L | B. | 一定大于0.1mol/L | ||
| C. | 一定小于0.1mol/L | D. | 无法确定 |
分析 酸溶液中氢离子浓度是0.1mol•L-1,溶质可能是弱酸、强酸,不同的溶质,其物质的量浓度会有所不同,故无法确定溶液的物质的量浓度.
解答 解:溶质若是弱酸,如醋酸,溶液的浓度大于0.1mol•L-1,
溶质是强酸,一元强酸中,如盐酸、硝酸,溶液中溶质的物质的量浓度等于0.1mol•L-1,
若是二元强酸,如硫酸,其物质的量浓度是0.05mol•L-1,
根据以上分析,无法确定溶液中溶质的物质的量浓度,
故选:D.
点评 本题考查了强弱电解质的电离,注重了基础知识的考查,把握酸的强弱及几元酸是解答的关键,题目难度不大.

练习册系列答案
相关题目
5.从节约原料,保护环境的角度来分析,要制取一定量的硝酸铜晶体,下列实验设计中最合理的是( )
| A. | Cu与4HNO3(浓)反应 | |
| B. | Cu与8HNO3(稀)反应 | |
| C. | Cu在空气加热后生成CuO,再将CuO与硝酸反应 | |
| D. | Cu在氯气加热后生成CuCl2,再将CuCl2溶于硝酸 |
12.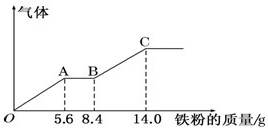 某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
 某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成甲、乙两份.向甲中逐渐加入铜粉,最多能溶解9.6g.向乙中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示(已知:Fe+4HNO3(稀)=Fe(NO3)+NO↑+2H2O),下列分析结果不正确的是( )| A. | 原混合溶液中NO${\;}_{3}^{-}$的物质的量的浓度为4mol/L | |
| B. | AB段的反应为:Fe+2Fe3+=3Fe2+ | |
| C. | C点时,乙中溶质为FeSO4 | |
| D. | 标准状况下,OA,OB段产生的气体总体积约为4.48L |
2.下列浓度关系错误的是( )
| A. | Na2C03溶液中:c(Na+)>c(C032-)>c(OH-)>c(HC03-)>c(H+) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:2c(Na+)=c(CH3COOH)+c(CH3C00-) | |
| C. | NaHC03溶液中:c(C032-)+c(OH-)=c(H+)+c(H2C03) | |
| D. | 氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO) |
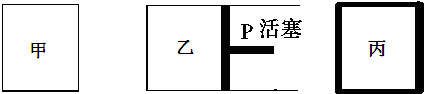
2.相同温度下,在体积相等的三个密闭容器甲、乙、丙中发生可逆反应:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
其中甲为恒温恒容容器,乙为恒温恒压容器、丙为恒容绝热容器;实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是( )
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
其中甲为恒温恒容容器,乙为恒温恒压容器、丙为恒容绝热容器;实验测得起始、平衡时的有关数据如下表:

| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 1 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
| A. | N2的转化率:丙是甲的二倍 | |
| B. | 三个容器内反应的平衡常数:甲=乙>丙 | |
| C. | 达平衡时氨气的体积分数:甲>乙>丙 | |
| D. | 放出热量关系:b<a<92.4 |




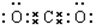
 .
.