题目内容
19. 实验室配制500mL 0.2mol.L-1Na2S04溶液,实验操作步骤如下:
实验室配制500mL 0.2mol.L-1Na2S04溶液,实验操作步骤如下:A.用托盘天平上称出14.2g硫酸钠固体,把它放在烧杯中,用适量的蒸馏水使它完全溶解并
冷却至室温
B.把溶解后得到的溶液转移至容量瓶中
C.继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管逐滴滴加蒸馏水至凹液
面最低点与刻度线相平切
D.用少量蒸馏水洗涤烧杯和玻璃棒各2~3次,每次的洗涤液都注入容量瓶中,并轻轻振荡
E.将容量瓶瓶塞塞紧,充分摇匀
回答下列问题:
(1)操作步骤的正确顺序为(填序号)ABDCE;
(2)本实验用到的基本仪器已有烧杯、托盘天平(带砝码)、药匙、玻璃棒,还缺少的仪器是500mL容量瓶和胶头滴管.
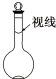
(3)下列情况会使所配溶液浓度偏高的是ad
a.某同学观察液面的情况如图所示
b.没有进行上述的操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上有锈
e.容量瓶使用前内壁附有水珠.
分析 (1)根据配制一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶来分析操作顺序;
(2)根据配制一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶来分析所需的仪器;
(3)分析具体操作对n、V的影响,根据c=分析不当操作对溶液浓度的影响.
解答 解:(1)根据配制一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶可知正确的操作的顺序为ABDCE,故答案为:ABDCE;
(2)根据配制一定物质的量浓度的溶液的步骤是称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶可知所需的仪器有托盘天平(带砝码)、药匙、烧杯、玻璃棒、500mL容量瓶和胶头滴管,故除了烧杯、托盘天平(带砝码)、药匙、玻璃棒,还需要的仪器有500mL容量瓶和胶头滴管,故答案为:500mL容量瓶、胶头滴管;
(3)a.某同学观察液面的情况如图所示,则溶液体积偏小,浓度偏高,故a正确;
b.没有进行上述的操作步骤D,则会导致溶质的损失,溶液浓度偏低,故b错误;
c.加蒸馏水时,不慎超过了刻度线,则溶液体积偏大,浓度偏低,故c错误;
d.砝码上有锈,则砝码的质量偏大,称量出的药品的质量偏大,溶液浓度偏高,故d正确;
e.容量瓶使用前内壁附有水珠,对溶液浓度无影响,故e错误.
故选ad.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,难度不大,掌握公式的运用和配制原理是解题的关键.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
10.中学化学实验,淡黄色的pH试纸常用于测定溶液的酸碱性.在 25℃,若溶液的pH=7,试纸不变色;若pH<7,试纸变红色;若pH>7,试纸变蓝色.而要精确测定溶液的pH,需用pH计.pH计主要通过测定溶液中H+浓度来测定溶液的pH.
(1)已知水中存在如下平衡H2O?H++OH-△H>0.现欲使平衡向右移动,且所得溶液呈中性,选择的方法是C(字母).
A.向水中加入NaHSO4溶液
B.向水中加入Cu(OH)2固体
C.加热水至100℃[其中c(H+)=1×10-6 mol•L-1]
D.在水中加入H2SO4溶液
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色,若用pH计测定,则pH<7 (填“>”“<”或“=”),溶液呈中性(填“酸”“碱”或“中”).
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断PM2.5的酸碱性为酸性,试样的pH=4.
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
(1)已知水中存在如下平衡H2O?H++OH-△H>0.现欲使平衡向右移动,且所得溶液呈中性,选择的方法是C(字母).
A.向水中加入NaHSO4溶液
B.向水中加入Cu(OH)2固体
C.加热水至100℃[其中c(H+)=1×10-6 mol•L-1]
D.在水中加入H2SO4溶液
(2)现欲测定100℃沸水的pH及酸碱性,若用pH试纸测定,则试纸显淡黄色,若用pH计测定,则pH<7 (填“>”“<”或“=”),溶液呈中性(填“酸”“碱”或“中”).
(3)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| $\frac{浓度}{(mol•{L}^{_1})}$ | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(4)①已知汽缸中生成NO的反应为N2(g)+O2(g)?2NO(g)△H>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是吸热反应,温度升高,平衡正向移动,NO的含量增大.
②汽车燃油不完全燃烧时产生CO,有人设计下列反应除去CO:2CO(g)=2C(s)+O2(g),已知该反应的△H>0,简述该设想能否实现的依据△H>0△S<0,则在任何温度下△G>0,不可能自发进行.
14.下雪时,常用融雪剂清理路面,醋酸钾(CH3COOK)是常用的融雪剂.下列四个选项中,关于1mol
CH3COOK的叙述正确的是( )
CH3COOK的叙述正确的是( )
| A. | CH3COOK的相对分子质量为98 mol-1 | |
| B. | CH3COOK的摩尔质量为98 g | |
| C. | 1 mol CH3COOK含有2 mol氧 | |
| D. | 1 mol CH3COOK含有3×6.02×1023个H |
4.下列有关物质检验的实验结论正确的是( )
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中加入盐酸,能产生使澄清石灰水变浑浊的气体 | 该溶液中一定含CO32- |
| C | 向某溶液中加入适量NaOH稀溶液,将湿润的红色石蕊试纸放在试管口,试纸不变色 | 该溶液中一定不含NH4+ |
| D | 用干燥洁净的铂丝蘸取某溶液放在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色 | 该溶液一定含有钾元素,可能含有钠元素 |
| A. | A | B. | B | C. | C | D. | D |
8.下列说法正确的是( )
| A. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成的 | |
| B. | 糖类、油脂、蛋白质都是天然的高分子化合物 | |
| C. | 植物油能使溴水褪色,氢化(加氢)可以变为脂肪 | |
| D. | 淀粉、蛋白质溶液均匀、稳定,不产生丁达尔效应 |
 如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.
如图是我校实验室化学试剂浓硫酸标签上的部分内容.现需要480mL 1mol•L-1的稀硫酸.用该浓硫酸和蒸馏水配制,可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④量筒.