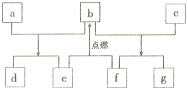
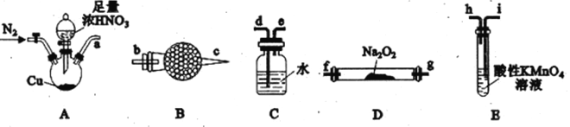题目内容
【题目】可逆反应N2(g)+3H2(g) ![]() 2NH3(g),△H=-Q kJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2kJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是
2NH3(g),△H=-Q kJ/mol(Q>0)。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1molN2和3molH2,在一定条件下达到平衡时放出热量为Q1kJ;在相同条件下,向乙容器中加入2molNH3达到平衡后吸收热量为Q2kJ,已知甲和乙两容器中所达到的平衡完全相同且Q1=4Q2。下列叙述不正确的是
A. 达平衡时,两容器中反应物的转化率不同,甲中N2和H2为80%,乙中NH3为20%
B. 甲中NH3的体积分数与乙相等
C. 达到平衡后,再向乙中加入0.2moLN2、0.6molH2、1.6molNH3,平衡向生成NH3的方向移动
D. 乙中的热化学反应方程式为2NH3(g) ![]() N2(g)+3H2(g);△H=+Q2kJ/mol
N2(g)+3H2(g);△H=+Q2kJ/mol
【答案】D
【解析】
A、由于1molN2和3molH2完全反应可以生成2molNH3,所以甲乙两个体系的平衡状态是一样的,即平衡时,三种气体的浓度完全相同。对于同一可逆反应,相同条件下,正反应的反应热与逆反应的反应热,数值相等,符号相反。假设N2和H2完全反应时放热Q,则NH3完全分解时吸热也是Q。假设甲容器中的参加反应的氮气的物质的量为xmol,所以:
对于甲容器:N2(g)+3H2(g)2NH3(g)△H=-QkJ/mol
起始(mol): 1 3 0
变化(mol): x 3x 2x
平衡(mol): 1-x 3-3x 2x
所以Q1=xQkJ,乙容器反应混合物各组分的物质的量也是为N2(1-x )mol、H2(3-3x )mol、NH32xmol,所以分解的NH3的物质的量为(2-2x)mol,对于乙容器:2NH3(g)N2(g)+3H2(g)△H=+QkJ/mol,故吸收的热量Q2=![]() ×QkJ=(1-x)QkJ,所以4(1-x)Q=xQ,解得x=0.8,所以N2的转化率为
×QkJ=(1-x)QkJ,所以4(1-x)Q=xQ,解得x=0.8,所以N2的转化率为![]() ×100%=80%,NH3的转化率为
×100%=80%,NH3的转化率为![]() ×100%=
×100%=![]() ×100% =20%,故A正确;B、甲乙容器中达到的平衡是相同平衡,所以氨气的体积分数相同,故B正确;C、依据A分析计算得到平衡物质的量N2为0.2mol,H2为0.6mol,NH3为1.6mol,再向乙中加入0.2mol N2(g)、0.6mol H2(g)和1.6mol NH3(g),相当于增大压强,平衡正向进行,故C正确;D、该反应是可逆反应,乙中反应的热化学方程式为2NH3(g)N2(g)+3H2(g)△H>+Q2kJ/mol,故D错误;故选D。
×100% =20%,故A正确;B、甲乙容器中达到的平衡是相同平衡,所以氨气的体积分数相同,故B正确;C、依据A分析计算得到平衡物质的量N2为0.2mol,H2为0.6mol,NH3为1.6mol,再向乙中加入0.2mol N2(g)、0.6mol H2(g)和1.6mol NH3(g),相当于增大压强,平衡正向进行,故C正确;D、该反应是可逆反应,乙中反应的热化学方程式为2NH3(g)N2(g)+3H2(g)△H>+Q2kJ/mol,故D错误;故选D。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才.现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产:N2(g)+3H2(g) ![]() 2NH3(g)△H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.
2NH3(g)△H<0.当改变某一外界条件(温度或压强)时,NH3的体积分数ψ(NH3)变化趋势如图所示.

回答下列问题:
(1)已知:①NH3(l)═NH3(g)△H1,②N2(g)+3H2(g) ![]() 2NH3(l)△H2;则反应N2(g)+3H2(g)
2NH3(l)△H2;则反应N2(g)+3H2(g) ![]() 2NH3(g)的△H=_____________(用含△H1、△H2的代数式表示);
2NH3(g)的△H=_____________(用含△H1、△H2的代数式表示);
(2)合成氨的平衡常数表达式为____________,平衡时,M点NH3的体积分数为10%,则N2的转化率为____________(保留两位有效数字) ;
(3)X轴上a点的数值比b点____________(填“大”或“小”)。上图中,Y轴表示____________(填“温度”或“压强”),判断的理由是____________;
(4)若将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件和平衡时的相关数据如表所示:
容器编号 | 实验条件 | 平衡时反应中的能量变化 |
Ⅰ | 恒温恒容 | 放热Q1kJ |
Ⅱ | 恒温恒压 | 放热Q2kJ |
Ⅲ | 恒容绝热 | 放热Q3kJ |
下列判断正确的是____________;
A.放出热量:Ql<Q2<△Hl B.N2的转化率:Ⅰ>Ⅲ
C.平衡常数:Ⅱ>Ⅰ D.达平衡时氨气的体积分数:Ⅰ>Ⅱ
(5)常温下,向VmL amol/L的稀硫酸溶液中滴加等体积bmol/L的氨水,恰好使混合溶液呈中性,此时溶液中c(NH4+)____________c(SO42-)(填“>”、“<”或“=”) ;
(6)利用氨气设计一种环保燃料电池,一极通入氨气,另一极通入空气,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-,写出负极的电极反应式____________。