题目内容
【题目】亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
I.利用下列装置制备NaNO2
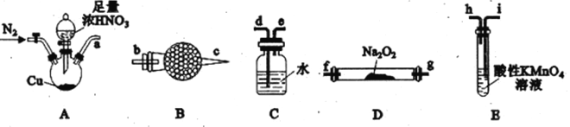
已知:①2NO+Na2O2=2NaNO2;②NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。请回答下列问题:
(1)利用上图中的装置制备NaNO2,其连接顺序为a→__________(按气流方向,用小写字母表示)。
(2)实验开始时,先通一段时间N2的目的是__________。
(3)装置B中盛放试剂的名称为__________,装置C的作用是__________。
(4)装置E中发生反应的离子方程式为____________________。
Ⅱ.测定上述实验所制备的NaNO2样品(含NaNO3杂质)的纯度。称量D中所得样品ag溶解后配制成250mL溶液取25.00mL于锥形瓶中,用bmoL-1酸性高锰酸钾溶液滴定到终点。重复上述滴定操作两次,测得数据如下表:
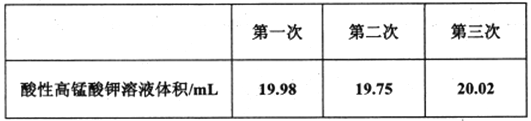
(5)滴定终点的实验现象为_________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是__________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2的质量分数为__________(用含a、b的关系式表示)。
【答案】d→e→b→c→f(或g)→g(或f)→i 排除装置中的空气,防止NO被氧化为NO2 碱石灰或无水氯化钙 将NO2转化为NO 5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O 溶液由无色变为紫色(或紫红色),且半分钟不褪色。 c 34.5b/a×100%
【解析】
(1)A装置发生铜与浓硝酸的反应生成NO2,通到C装置中,NO2与水反应生成NO,然后进入B装置进行干燥,干燥完进入D装置和Na2O2反应,最后进入E装置进行尾气处理。
(2)实验开始时,先通一段时间N2的目的是:排除装置中的空气,防止NO被氧化为NO2。
(3)装置B是干燥NO。
(4)装置E中发生NO和酸性KMnO4溶液的反应,NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。
(5)NaNO2与酸性高锰酸钾溶液的离子反应为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2+ +3H2O。
(6)酸性高锰酸钾溶液应放在酸式滴定管中,NaNO2样品溶液放在锥形瓶中,第二次实验数据偏小,即V(标)偏小。
(7)第二次实验数据误差较大,故舍去,酸性高锰酸钾溶液的平均体积为:(19.98mL+20.02mL)/2=20mL,根据方程式:5NO2-+2MnO4-+6H+=5NO3-+2Mn2+ +3H2O来解答。
(1)A装置发生铜与浓硝酸的反应生成NO2,通到C装置中,NO2与水反应生成NO,然后进入B装置进行干燥,干燥完进入D装置和Na2O2反应,最后进入E装置进行尾气处理,所以连接顺序为a→d→e→b→c→f(或g)→g(或f)→i,故答案为:d→e→b→c→f(或g)→g(或f)→i。
(2)实验开始时,先通一段时间N2的目的是:排除装置中的空气,防止NO被氧化为NO2,故答案为:排除装置中的空气,防止NO被氧化为NO2。
(3)装置B是干燥NO,应盛放试剂的名称为碱石灰或无水氯化钙,装置C中NO2和水反应生成硝酸和NO,故答案为:碱石灰或无水氯化钙;将NO2转化为NO。
(4)装置E中发生NO和酸性KMnO4溶液的反应,NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+,反应的离子方程式为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O。
(5)NaNO2与酸性高锰酸钾溶液的离子反应为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2+ +3H2O,滴定终点的实验现象为:溶液由无色变为紫色(或紫红色),且半分钟不褪色,故答案为:溶液由无色变为紫色(或紫红色),且半分钟不褪色。
(6)酸性高锰酸钾溶液应放在酸式滴定管中,NaNO2样品溶液放在锥形瓶中,第二次实验数据(酸性高锰酸钾溶液体积)偏小.
a. 滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外,酸性高锰酸钾溶液体积偏大,故a不可能;
b. 加入样品溶液前的锥形瓶是否干燥对实验没有影响,故b不可能;
c. 滴定前仰视读数,滴定后俯视读数,读数出现错误,可以导致酸性高锰酸钾溶液体积V(标)偏小,故c可能。
故选c。
(7)第二次实验数据误差较大,故舍去,酸性高锰酸钾溶液的平均体积为:(19.98mL+20.02mL)/2=20mL,根据方程式:
5NO2-+2MnO4-+6H+=5NO3-+2Mn2+ +3H2O,
5mol 2mol
x 20 mL×10-3×bmoL/L
解得x=0.05bmol,原样品中NaNO2的物质的量为0.5bmol,所以NaNO2的质量分数为(0.5bmol×69g/mol/ag)×100%=34.5b/a×100%,故答案为:34.5b/a×100%。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 | |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍 | A的相对分子质量为________ | |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g 和13.2 g | A的分子式为__________ | |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) | 用结构简式表示A中含有的官能团:________、________ | |
(4)A的1H核磁共振谱如图: | A中含有______种氢原子 | |
(5)综上所述,A的结构简式为__________其中手性碳原子______个 | ||
.
