题目内容
【题目】Ⅰ、某温度时,在一个 10L 的恒容容器中,X、Y、Z 均为气体,三种物质的物 质的量随时间的变化曲线如图所示.根据图中数据填空:
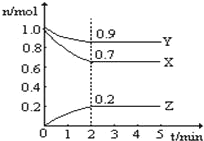
(1)该反应的化学方程式为______;
(2)反应开始至 2min,以气体 Z 表示的平均反应速率为______;
(3)平衡时容器内混合气体密度比起始时______(填“变大”,“变小”或“不变” 下同),混合气体的平均相对分子质量比起始时__________;
(4)将 a mol X 与 b mol Y 的混合气体发生上述反应,反应到某时刻各物质的量恰好满足: n(X)=n(Y)=2n(Z),则原混合气体中 a:b=______。
Ⅱ、在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合 气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜 色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明 2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_____(填序号,下同)。
2SO3(g)达到平衡状态的是_____(填序号,下同)。
(2)一定能证明 I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 ______。
2HI(g)达到平衡状态的是 ______。
(3)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是______。(B C D 均无色)
C(g)+D(g)达到平衡状态的是______。(B C D 均无色)
III 、某化学反应 2A![]() B+D 在四种条件下进行,B、D 起始浓度为 0,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如表:
B+D 在四种条件下进行,B、D 起始浓度为 0,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800 | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
比较实验 4 和实验 1 可推测该正反应是_____反应(填“吸热”或“放热”)。 理由_________
【答案】3X+Y2Z 0.01mol/(Lmin) 不变 变大 7∶5 ①③④ ⑤ ②④ 吸热 由实验1到实验4升高温度,平衡时反应物A的浓度减小,说明平衡右移,则正反应为吸热反应
【解析】
I.(1)根据图象判断出反应物和生成物,再根据化学方程式中反应的物质系数之比等于各个物质的量的变化量之比书写方程式;
(2)根据化反应速率v=![]() 计算;
计算;
(3) 混合气体密度ρ=![]() ,混合气体的平均相对分子质量M=
,混合气体的平均相对分子质量M=![]() ,据此分析判断;
,据此分析判断;
(4)根据化学反应中的三段式进行计算;
Ⅱ、根据化学平衡状态的特征分析判断;
III 、根据温度对化学平衡移动的影响分析判断。
I.(1)根据图示,X和Y是反应物,Z是生成物,X、Y、Z的变化量之比是0.3∶0.1∶0.2=3∶1∶2,最终三者同时存在,为可逆反应,反应的化学方程式为:3X+Y2Z,故答案为:3X+Y2Z;
(2)反应开始至2min,以气体Z表示的平均反应速率v= =0.01mol/(Lmin),故答案为:0.01mol/(Lmin);
=0.01mol/(Lmin),故答案为:0.01mol/(Lmin);
(3)混合气体密度ρ=![]() ,从开始到平衡,质量是守恒的,气体的体积不变,所以密度始终不变;混合气体的平均相对分子质量M=
,从开始到平衡,质量是守恒的,气体的体积不变,所以密度始终不变;混合气体的平均相对分子质量M=![]() ,气体的质量不变,但混合气体的物质的量减小,则M变大,故答案为:不变;变大;
,气体的质量不变,但混合气体的物质的量减小,则M变大,故答案为:不变;变大;
(4)设Y物质的量的变化量是x,
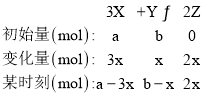
当n(X)=n(Y)=2n(Z)时,a-3x=b-x=4x,则a=7x,b=5x,所以原混合气体中a∶b=7∶5,故答案为:7∶5;
Ⅱ、(1)对于反应2SO2(g)+O2(g)2SO3(g),①混合气体的压强不再发生变化,说明气体的物质的量不变,反应达平衡状态,故①正确;②混合气体的质量和体积始终不变,则气体的密度始终不变,不能说明达平衡状态,故②错误;③反应后气体的物质的量减少,则混合气体的总物质的量不变,反应达平衡状态,故③正确;④混合气体的平均相对分子质量,说明气体的物质的量不变,反应达平衡状态,故④正确;⑤反应物和生成物均为无色,混合气体的颜色一直不变,不能说明达平衡状态,故⑤错误;⑥只要反应发生就有各反应物或生成物的反应速率之比等于化学计量数之比,不能说明达平衡状态,故⑥错误;故答案为:①③④;
(2)对于反应I2(g)+H2(g)2HI(g),①混合气体的压强一直不变,不能说明达平衡状态,故①错误;②混合气体的密度一直不变,不能说明达平衡状态,故②错误;③混合气体的总物质的量一直不变,不能说明达平衡状态,故③错误;④混合气体的平均相对分子质量一直不变,不能说明达平衡状态,故④错误;⑤混合气体的颜色不变,说明碘蒸气的浓度不变,反应达平衡状态,故⑤正确;⑥只要反应发生就有各反应物或生成物的反应速率之比等于化学计量数之比,不能说明达平衡状态,故⑥错误;故答案为:⑤;
(3)对于反应A(s)+2B(g)C(g)+D(g),A为固体。①混合气体的压强一直不变,不能说明达平衡状态,故①错误;②反应后气体的质量增大,体积不变,混合气体的密度不变,说明气体的质量不变,反应达平衡状态,故②正确;③混合气体的总物质的量一直不变,不能说明达平衡状态,故③错误;④混合气体的平均相对分子质量不变,说明气体的质量不变,反应达平衡状态,故④正确;⑤反应物和生成物均为无色,混合气体的颜色一直不变,不能说明达平衡状态,故⑤错误;⑥只要反应发生就有各反应物或生成物的反应速率之比等于化学计量数之比,不能说明达平衡状态,故⑥错误;故答案为:②④;
III 、比较实验4和实验1可知,平衡时实验4反应物A的浓度小,由实验1到实验4,升高温度,平衡右移,而升高温度平衡向吸热反应方向移动,因此正反应为吸热反应,故答案为:吸热;由实验1到实验4升高温度,平衡时反应物A的浓度减小,说明平衡右移,则正反应为吸热反应。

 步步高达标卷系列答案
步步高达标卷系列答案