题目内容
【题目】下列说法正确的是( )
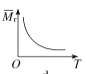
A.测定HCl和NaOH中和反应的反应热时,单次实验均应测量3个温度,即盐酸起始温度、NaOH溶液起始温度和反应终止温度
B.2C(s)+O2(g)=2CO(g) 若△H=-221.0kJ/mol,则碳的燃烧热为110.5kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知Ⅰ:反应H2(g)+Cl2(g)=2HCl(g) △H=-akJ/mol;Ⅱ:![]() ,
,![]() 且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a-b-c)kJ/mol
且a、b、c均大于零,则断开1molH-Cl键所需的能量为2(a-b-c)kJ/mol
【答案】A
【解析】
A.中和热测定实验中,需要测定反应前酸碱溶液温度和反应后最高温度(即终止温度),总共3个温度,A项正确;
B.碳对应的稳定氧化物为二氧化碳,该反应生成一氧化碳,该反应热不是碳的燃烧热,B项错误;
C.放热反应有的也需要一定条件才能发生,如氢气和氧气需要点燃发生反应,常溫下能发生的反应也不一定是放热反应,如氢氧化钡和氯化铵晶体的反应在常温下就能进行,但其为吸热反应,C项错误;
D.依据反应焓变=反应物的总键能之和-生成物的总键能之和,设断开1molH-Cl键所需的能量为x,可知,△H=b+c-2x=-akJ/mol,解得x=![]() ,则断开1molH-Cl键能所吸收能量为
,则断开1molH-Cl键能所吸收能量为![]() ,D项错误;
,D项错误;
答案选A。

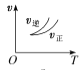
【题目】Ⅰ、某温度时,在一个 10L 的恒容容器中,X、Y、Z 均为气体,三种物质的物 质的量随时间的变化曲线如图所示.根据图中数据填空:
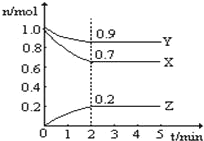
(1)该反应的化学方程式为______;
(2)反应开始至 2min,以气体 Z 表示的平均反应速率为______;
(3)平衡时容器内混合气体密度比起始时______(填“变大”,“变小”或“不变” 下同),混合气体的平均相对分子质量比起始时__________;
(4)将 a mol X 与 b mol Y 的混合气体发生上述反应,反应到某时刻各物质的量恰好满足: n(X)=n(Y)=2n(Z),则原混合气体中 a:b=______。
Ⅱ、在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合 气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜 色,⑥各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明 2SO2(g)+O2(g)![]() 2SO3(g)达到平衡状态的是_____(填序号,下同)。
2SO3(g)达到平衡状态的是_____(填序号,下同)。
(2)一定能证明 I2(g)+H2(g)![]() 2HI(g)达到平衡状态的是 ______。
2HI(g)达到平衡状态的是 ______。
(3)一定能证明 A(s)+2B(g)![]() C(g)+D(g)达到平衡状态的是______。(B C D 均无色)
C(g)+D(g)达到平衡状态的是______。(B C D 均无色)
III 、某化学反应 2A![]() B+D 在四种条件下进行,B、D 起始浓度为 0,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如表:
B+D 在四种条件下进行,B、D 起始浓度为 0,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800 | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
比较实验 4 和实验 1 可推测该正反应是_____反应(填“吸热”或“放热”)。 理由_________
【题目】下列实验不能达到预期目的的是
选项 | 实验操作 | 预期目的 |
A | 充满NO2的密闭玻璃球分别浸泡在冷、热水中 | 研究温度对化学平衡移动的影响 |
B | 向盛有 1 mL 硝酸银溶液的试管中滴加 NaCl 溶液至不再有沉淀产生,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种更难溶的沉淀 |
C | 苯酚和水的浊液中,加稍过量浓碳酸钠溶液 | 比较苯酚与碳酸的酸性 |
D | 向2支试管中加入同体积同浓度H2C2O4溶液, 再分别加入同体积不同浓度的酸性KMnO4溶液 | 依据褪色时间来研究浓度对反应速率的影响 |
A.AB.BC.CD.D