题目内容
【题目】含氮化合物在工农业生产、生活中有重要作用。
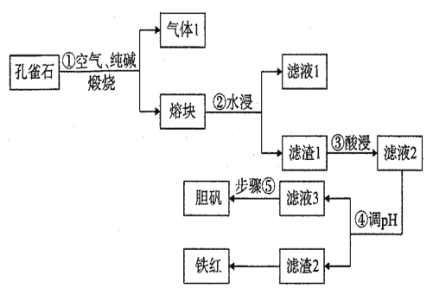
Ⅰ.有资料显示过量的NH3和Cl2在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备
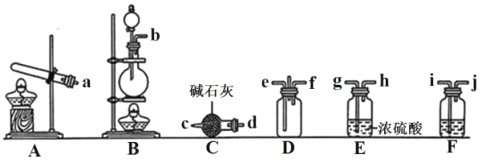
①利用装置A制取实验所需的NH3,写出反应的化学方程式__。
②已知该实验中用浓盐酸与MnO2反应制取所需Cl2,其离子反应方程式为__;装置F中的试剂是__。(填名称)
③为了使NH3和Cl2在D中充分混合,则由__(填e或f)通入NH3;请确定上述装置的合理连接顺序:A→__→D←__←__←__(用大写字母和箭头表示,箭头方向与气流方向一致)。
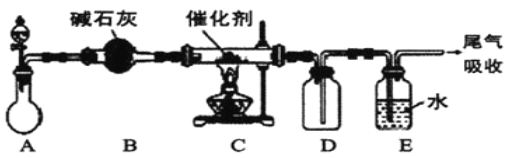
Ⅱ.(1)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):
①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是__。(填化学式)
②C装置中发生反应的化学方程式为__。
③反应后,装置E中除存在较多的H+外,还可能存在的一种阳离子是__,该离子的检验方法为__。
④下列哪些装置可以同时起到装置D和E的作用__(填代号)。
a.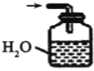 b.
b.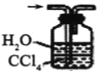 c.
c.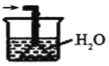 d.
d.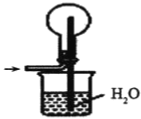
Ⅲ.饮用水中的NO3-对人类健康会产生危害。为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原成N2。
(1)配平方程式:__Al+__NO3-+__OH-=__AlO2-+__N2↑+__H2O。
(2)上述反应中,当有0.3mol电子转移时,产生的氮气在标准状况下的体积为__mL。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O MnO2+4H++2Cl-
CaCl2+2NH3↑+2H2O MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 饱和食盐水 e C E F B Na2O2 4NH3+5O2
Mn2++Cl2↑+2H2O 饱和食盐水 e C E F B Na2O2 4NH3+5O2![]() 4NO+6H2O NH4+ 取E中少许溶液放入一支洁净试管中,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明溶液中含有NH4+ b 10 6 4 10 3 2 672
4NO+6H2O NH4+ 取E中少许溶液放入一支洁净试管中,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明溶液中含有NH4+ b 10 6 4 10 3 2 672
【解析】
(1)①装置A是用氯化铵和氢氧化钙反应制取NH3,反应方程式是2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
②浓盐酸与MnO2加热生成氯化锰、氯气、水,反应的离子方程式是MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;装置F的作用是除去氯气中的氯化氢,盛放的试剂是饱和食盐水;
Mn2++Cl2↑+2H2O;装置F的作用是除去氯气中的氯化氢,盛放的试剂是饱和食盐水;
③氨气的密度比氯气小,为了使NH3和Cl2在D中充分混合,长管通入氨气、短管通入氯气,即由e通入NH3;A制取氨气经C干燥后通入D,B中制取的氯气经F除去氯化氢、再经E干燥后通入D,合理连接顺序:A→C→D←E←F←B;
Ⅱ.(1)①氨气和氧气在催化剂条件下发生催化氧化,所以A装置中能同时制备氨气和氧气; A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是Na2O2;
②C装置中氨气和氧气在催化剂条件下加热生成一氧化氮和水,发生反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
③反应后,氨气可能进入E,E中的阳离子可能是NH4+;铵根离子遇碱放出氨气,检验铵根离子的方法是:取E中少许溶液放入一支洁净试管中,加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明溶液中含有NH4+;
④a装置气体吸收不充分,故不选a;b装置,二氧化氮、氨气不溶于四氯化碳,b可以同时起到装置D和E的作用,故选b;c装置不能防倒吸,故不选c;d装置不能防倒吸,故不选d;
Ⅲ.(1)铝元素化合价由0升高为+3、氮元素化合价由+5降低为0,根据得失电子守恒、电荷守恒配平离子方程式10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O。
(2)10Al+6NO3-+4OH-=10AlO2-+3N2↑+2H2O,氮元素化合价由+5降低为0,生成1molN2转移10mol电子,当有0.3mol电子转移时,产生的氮气的物质的量是0.03mol,在标准状况下的体积为0.03mol×22.4L/mol=0.672L=672mL。

 走进文言文系列答案
走进文言文系列答案