题目内容
【题目】某固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3,某同学设计并完成如下实验:(所加试剂均过量)

已知:蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色。
请回答:
(1)白色沉淀是__________________(填化学式)。
(2)生成红褐色沉淀的离子方程式为______________________。
(3)根据实验现象, 固体粉末中一定存在的组分是___________________________ (填化学式)。
【答案】(1)CaCO3;(2)Fe3++3OH—= Fe(OH)3↓;(3)SiO2、Fe2O3、K2CO3;
【解析】试题分析:固体粉末中可能含有SiO2、Fe2O3、CuO、NaHCO3、K2CO3,由实验流程可知,加盐酸生成的气体能使石灰水变浑浊,则气体为CO2,溶液1与NaOH反应生成红褐色沉淀,沉淀为氢氧化铁,则原固体一定含Fe2O3,可知没有CuO,与盐酸反应后得到的固体为SiO2,又蘸取少量溶液2在酒精灯上灼烧,透过蓝色钴玻璃观察火焰呈紫色,为K的焰色反应,则原固体中含K2CO3。
(1)白色沉淀为二氧化碳与氢氧化钙反应生成的CaCO3,故答案为:CaCO3;
(2)生成红褐色沉淀的离子方程式为Fe3++3OH-=Fe(OH)3↓,故答案为:Fe3++3OH-=Fe(OH)3↓;
(3)由上述分析可知,一定含SiO2、Fe2O3、K2CO3,可能含NaHCO3,一定不含CuO,故答案为:SiO2、Fe2O3、K2CO3

【题目】过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为
CO(NH2)2+H2O2![]() CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
CO(NH2)2·H2O2 | 白色 晶体 | 45 ℃ | 75~85 ℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:
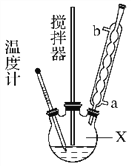
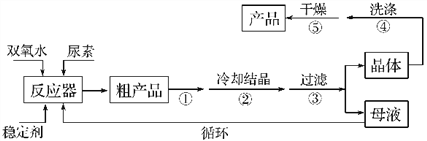
请回答下列问题:
(1)仪器X的名称是________;冷凝管中冷却水从________(填“a”或“b”)口出来。
(2)该反应的温度控制30 ℃而不能过高的原因是_____________________。
(3)步骤①宜采用的操作是________(填字母)。
A.加热蒸发 B.常压蒸发 C.减压蒸发
(4)若实验室制得少量该晶体,过滤后需要用冷水洗涤,具体的洗涤操作是______________________________。
(5)准确称取1.000 g产品于250 mL锥形瓶中,加适量蒸馏水溶解,再加2 mL 6 mol·L-1H2SO4,用0.200 0 mol·L-1 KMnO4标准溶液滴定至终点时消耗18.00 mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2·H2O2的质量分数为________;若滴定后俯视读数,则测得的过氧化尿素含量________(填“偏高”“偏低”或“不变”)。



