��Ŀ����
��8�֣���t��ʱ����3molA��2molB����ͨ�����Ϊ2L���ܱ�������(�ݻ�����)���������·�Ӧ��3A (g)+B (g) 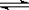 x C(g)��2minʱ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��ʣ��1.8molB�������C��Ũ��Ϊ0.4mol/L���ݴ���д���¿հף�
x C(g)��2minʱ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��ʣ��1.8molB�������C��Ũ��Ϊ0.4mol/L���ݴ���д���¿հף�
��1��v(B) = mol/(L��min)�� x��ֵ= ��
��2���Ƚϴﵽƽ��ʱ��A��B����Ӧ���ת����֮��Ϊ��(A)����(B)�� ��
��3����������ԭƽ�������������ͨ������������(������A��B��C������Ӧ)��������˵������ȷ����____________(��д��ĸ���)
A����ѧƽ��������Ӧ�����ƶ� B����ѧƽ�����淴Ӧ�����ƶ�
C����ѧƽ�ⲻ�ᷢ���ƶ� D������A��Ũ�Ȼ��С
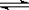 x C(g)��2minʱ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��ʣ��1.8molB�������C��Ũ��Ϊ0.4mol/L���ݴ���д���¿հף�
x C(g)��2minʱ��Ӧ�ﵽƽ��״̬(�¶Ȳ���)��ʣ��1.8molB�������C��Ũ��Ϊ0.4mol/L���ݴ���д���¿հף���1��v(B) = mol/(L��min)�� x��ֵ= ��
��2���Ƚϴﵽƽ��ʱ��A��B����Ӧ���ת����֮��Ϊ��(A)����(B)�� ��
��3����������ԭƽ�������������ͨ������������(������A��B��C������Ӧ)��������˵������ȷ����____________(��д��ĸ���)
A����ѧƽ��������Ӧ�����ƶ� B����ѧƽ�����淴Ӧ�����ƶ�
C����ѧƽ�ⲻ�ᷢ���ƶ� D������A��Ũ�Ȼ��С
��1��0.05 4 ��2��2��1��3��C
�����������1��ƽ��ʱB����0.2mol������C0.8mol������x=4��B�ķ�Ӧ����Ϊ0.1/2 mol/(L��min)="0.05" mol/(L��min)��
��2��ƽ��ʱA����0.6mol��Aת����Ϊ20%��Bת����Ϊ10%��A��Bת����֮��Ϊ2��1��
��3������������ͨϡ�����壬�����Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���
���������¶���ʱ��ͨϡ�����壬ƽ�ⲻ�ƶ������¶�ѹʱͨϡ�����壬�൱�ڼ�ѹ��

��ϰ��ϵ�д�
�����Ŀ
 2C(g)��4D(g)����H<0�ﵽƽ�⣨��ʱ��V(��)=1.21V L����ش�
2C(g)��4D(g)����H<0�ﵽƽ�⣨��ʱ��V(��)=1.21V L����ش�
 2C(g)��D(g),����aΪ����������Ӧ�����У���������������ʱ��C�İٷֺ�����C�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ,����������ȷ����
2C(g)��D(g),����aΪ����������Ӧ�����У���������������ʱ��C�İٷֺ�����C�������¶ȣ�T����ѹǿ��P���Ĺ�ϵ��ͼ,����������ȷ����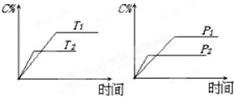
 PCl5(g) ��Ӧ�ﵽƽ��ʱ������ѹǿΪ��ʼʱ��6/7�����ʱ��
PCl5(g) ��Ӧ�ﵽƽ��ʱ������ѹǿΪ��ʼʱ��6/7�����ʱ�� 2AB��g���ﵽƽ��״̬�ı�־�ǣ�( )
2AB��g���ﵽƽ��״̬�ı�־�ǣ�( ) zC
zC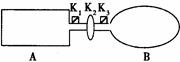
 N2O4����H<0������������϶�ƽ���ƶ���Ӱ�� )
N2O4����H<0������������϶�ƽ���ƶ���Ӱ�� )  N2O4��g�� ��H��0
N2O4��g�� ��H��0 NH3��g��+H2O��g��+CO2��g�� ��H��0
NH3��g��+H2O��g��+CO2��g�� ��H��0 xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף�
xC(g)+2D(g)��2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף�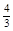 mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ����________����_________mol
mol��Ҫʹƽ��ʱ�����ʵ�����������ԭƽ��ʱ��ȫ��ȣ���Ӧ����________����_________mol