题目内容
14.在蒸发皿中加热蒸干并灼热(低于400℃)下列物质的溶液,可以得到该物质固体的是( )| A. | 氯化镁 | B. | 偏铝酸钠 | C. | 碳酸铵 | D. | 高锰酸钾 |
分析 A.MgCl2是强酸弱碱盐,Mg 2+易水解生成Mg(OH)2和盐酸,升高温度促进盐酸挥发,蒸干溶液得到氢氧化镁,灼烧Mg(OH)2,Mg(OH)2分解;
B.NaAlO2是强碱弱酸盐,AlO2-水解生成HAlO2和NaOH,因为HAlO2没有挥发性,所以蒸干溶液得到的固体是NaAlO2,NaAlO2受热不易分解;
C.碳酸铵受热易分解生成二氧化碳、氨气和水;
D.高锰酸钾受热易分解生成锰酸钾、二氧化锰和氧气.
解答 解:A.MgCl2是强酸弱碱盐,Mg 2+易水解生成Mg(OH)2和盐酸,升高温度促进盐酸挥发,蒸干溶液得到氢氧化镁,灼烧Mg(OH)2,Mg(OH)2分解生成MgO,所以蒸干、灼烧氯化镁溶液得到的固体是MgO,故A错误;
B.NaAlO2是强碱弱酸盐,AlO2-水解生成HAlO2和NaOH,因为HAlO2没有挥发性,所以蒸干溶液得到的固体是NaAlO2,NaAlO2受热不易分解,所以蒸干、灼烧偏铝酸钠溶液得到的固体是NaAlO2,故B正确;
C.碳酸铵受热发生的反应为NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑,所以蒸干灼烧碳酸氢铵溶液得不到原溶质,故C错误;
D.高锰酸钾受热发生的反应为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,所以蒸干灼烧高锰酸钾溶液得不到高锰酸钾,故D错误;
故选B.
点评 本题以盐类水解为载体考查元素化合物知识,为高频考点,明确物质的性质是解本题关键,只有受热不易分解且水解生成的酸没有挥发性的盐溶液蒸干灼烧得到原来物质,易错选项是D.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
4.下列说法中不正确的是( )
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | Na2CO3比NaHCO3稳定 | |
| C. | 氯化钙能与Na2CO3反应,也能与NaHCO3反应 | |
| D. | 与足量盐酸反应要得到相同质量的CO2,用NaHCO3比Na2CO3的质量要少 |
5.下列事实不能用勒夏特列原理解释的是( )
| A. | 往氢硫酸溶液中加入烧碱,有利于c(S2-)增大 | |
| B. | 经粉碎的黄铁矿燃烧得较快、较完全 | |
| C. | 实验室用排饱和食盐水的方法收集氯气 | |
| D. | 合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 |
19.(一)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数
回答下列问题:
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”、“不变”).
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是K1>K2>K3;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因多元弱酸分步电离,上一级电离产生的H+抑制下一级的电离,所以碳酸的二级电离常数小于一级电离常数:H2CO3?H++HCO3-,HCO3-?H++CO32-.
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L CH3COOH的电离转化率为α,则该温度下醋酸的电离平衡常数K=${\;}_{C{H}_{3}COOH}$$\frac{c{α}^{2}}{1-α}$.
(二)化合物SOCl2是一种液态化合物,沸点77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.
(1)写出SOCl2和水反应的化学方程式:SOCl2+H2O=SO2↑+2HCl.
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是Al2O3;用SOCl2与AlCl3•6H2O混合共热得到无水AlCl3,原因是因为当与SOCl2混合共热时,由于SOCl2极易吸水,防止AlCl3的水解,同时产生的HCl也可以抑制AlCl3的水解.
| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.31×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)K只与温度有关,当温度升高时,K值增大(填“增大”、“减小”、“不变”).
(2)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(3)对于同一种多元弱酸,有不止一个电离平衡常数,多个常数K1、K2、K3、之间存在某种大小关系,此关系是K1>K2>K3;以碳酸为例,用离子方程式和必要的文字说明产生此规律的原因多元弱酸分步电离,上一级电离产生的H+抑制下一级的电离,所以碳酸的二级电离常数小于一级电离常数:H2CO3?H++HCO3-,HCO3-?H++CO32-.
(4)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L CH3COOH的电离转化率为α,则该温度下醋酸的电离平衡常数K=${\;}_{C{H}_{3}COOH}$$\frac{c{α}^{2}}{1-α}$.
(二)化合物SOCl2是一种液态化合物,沸点77℃.在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出.该气体可使滴有品红试液的滤纸褪色.
(1)写出SOCl2和水反应的化学方程式:SOCl2+H2O=SO2↑+2HCl.
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要固体产物是Al2O3;用SOCl2与AlCl3•6H2O混合共热得到无水AlCl3,原因是因为当与SOCl2混合共热时,由于SOCl2极易吸水,防止AlCl3的水解,同时产生的HCl也可以抑制AlCl3的水解.
6.设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有( )
| A. | 12g金刚石中含4NA个C-C共价键 | |
| B. | 2L 0.5 moI.L-1盐酸溶液所含的HCI分子数目为NA | |
| C. | 标准状况下,2.24LCL4含有的原子数为0.5NA | |
| D. | 7.1 gCL2与5.6 g Fe反应,转移的电子总数为0,2NA |
3.如图表示从混合物中分离出X的两种方案,根据方案I和方案Ⅱ下列说法合理的是( )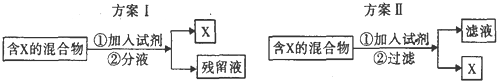

| A. | 若含X的混合物为碘水,可通过方案I进行分离,加入试剂为CC14液体,充分振荡后液体分层,上层为X的CC14溶液 | |
| B. | 若含X的混合物为乙醇和水,可通过方案Ⅱ进行分离,加入试剂为生石灰 | |
| C. | 若含X的混和物为KNO3和NaCl,可通过方案II进行分离,加入试剂为适量沸水 | |
| D. | 若含X的混合物为皂化反应后的混合物,可通过方案I进行分离,加入试剂为饱和食盐水,残留液中含有甘油 |
4.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为:下列说法正确的是( )
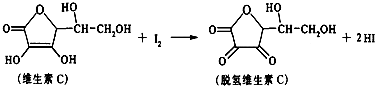
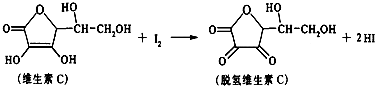
| A. | 上述反应为取代反应 | B. | 滴定时可用淀粉溶液作指示剂 | ||
| C. | 滴定时应剧烈振荡锥形瓶 | D. | 脱氢维生素C的分子式为C6H7O6 |
