题目内容
【题目】钒是人体必需的微量元素,能预防突发性心脏病等疾病,常见化合价有+2、+3、+4和+5。实验室模拟工业生产制备V2(CO3)3的步骤如下:
①取18.20gV2O5放入水中搅拌形成悬浊液,通入二氧化硫充分反应可得V2(SO4)3溶液。
②将V2(SO4)3溶液与足量的碳酸钠溶液混合,充分反应后过滤洗涤、干燥,得V2(CO3)3固体22.56g。
已知:+5价Ⅴ具有氧化性,+3价V具有还原性,易被氧气氧化。
回答下列问题:
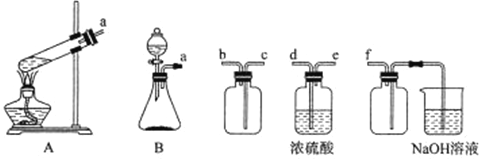
(1)实验室用Na2SO3固体和H2SO4(浓)制取SO2,可选用的发生装置是___________(填A或B),若利用下述装置制取并收集干燥的SO2,连接顺序为a→___________→___________→___________→___________→f。
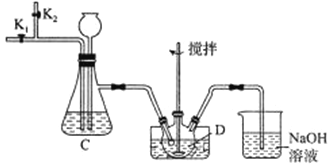
(2)步骤①实验装置如下:
①图中利用水浴处理的优点是___________,装置C中长颈漏斗的作用是___________。
②通入二氧化硫前和实验结束后都要通入N2,目的是___________。
③写出仪器D中反应的离子方程式___________。
(3)步骤②中洗涤操作后,证明已经洗净的操作是___________,本实验中的产率为___________。
【答案】B d e c b 便于控制温度、受热均匀 维持气压,防止装置堵塞 通入二氧化硫前通入氮气目的是赶尽装置内的空气,实验结束后通入氮气是为了赶走装置内的二氧化硫,防止污染 2SO2+V2O5+2H+=2SO42-+2V3++H2O 取最后一次洗涤液,向其中滴加稀盐酸和氯化钡溶液,若没有白色沉淀生,则已经洗净 80.00%
【解析】
(1)制取二氧化硫,为典型的固液不加热装置,选择B;按制取、干燥、收集、处理尾气的顺序连接装置;
(2)①图中利用水浴处理的优点是:便于控制温度、受热均匀;装置C中长颈漏斗的作用是:维持气压,防止装置堵塞。
②通入二氧化硫前通入氮气目的是赶尽装置内的空气,实验结束后通入氮气是为了赶走装置内的二氧化硫,防止污染。
③仪器D中反应的离子方程式SO2和V2O5在酸性条件下反应生成SO42-和V3+。
(3)V2(CO3)3沉淀表面吸附有可溶性的硫酸根和钠离子,因此可用稀盐酸和氯化钡溶液检验硫酸根的存在。根据钒守恒,由关系式计算V2O5~V2(CO3)3。
(1)用亚硫酸钠固体和浓硫酸反应制取二氧化硫,为典型的固液不加热装置,故选B;制取的二氧化硫应先干燥再收集,故先通过d、e,二氧化硫的密度比空气大,要从c口进气,b口出来进行尾气处理,因为二氧化硫易于氢氧化钠反应,故f的作用是安全瓶,防止倒吸;盛放NaOH溶液的烧杯为尾气处理装置要放置在最后;
(2)水浴处理,利用水的比热容大,可控制温度,同时使仪器受热均匀,由于通入气体过快或导管堵塞,可造成装置内压强过大,装置C中长颈漏斗的作用是为了平衡压强;依题意,+3价V具有还原性,易被氧气氧化,实验前要先通入氮气赶尽空气,二氧化硫有毒,实验结束后要通入N2,赶尽二氧化硫,使其完全被吸收;依题意,V2O5与二氧化硫在水中反应生成V2(SO4)3,根据电子守恒和电荷守恒可得离子方程式:2SO2+V2O5+2H+=2SO42-+2V3++H2O;
(3)V2(CO3)3沉淀表面吸附有可溶性的硫酸根和钠离子,因此可用稀盐酸和氯化钡溶液检验硫酸根的存在:取最后一次洗涤液,向其中滴加稀盐酸和氯化钡溶液,若没有白色沉淀生,则已经洗净;根据钒守恒,可得V2O5~V2(CO3)3,则18.20gV2O5完全反应可得V2(CO3)3的质量为28.20g,故产率为22.56g/28.20g×100%=80.00%。