题目内容
【题目】用于合成树脂的四溴双酚F、药物透过性材料高分子化合物PCL合成如下。

(1)W中—R是_________________________________。
(2)A的结构简式是_____________________________。
(3)A生成B和CH3COOH的反应类型是________________________。
(4)D→X过程中所引入的官能团分别是_________________________。
(5)E的分子式是C6H10O,E与H2反应可生成X。H的结构简式是____________________。
(6)有机物Y的苯环上只有2种不同化学环境的氢原子。
① 由B生成Y的反应方程式是___________________________________。
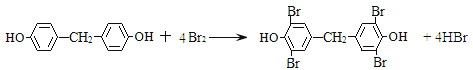
② 由Y生成四溴双酚F的反应方程式是_______________________________。
③ 在相同条件下,由B转化成四溴双酚F的过程中有副产物生成,该副产物是四溴双酚F的同分异构体,其结构简式可能是_________________________________。
(7)高分子化合物PCL的结构简式是_________________________________。
【答案】 甲基(或—CH3) ![]() 取代反应(水解反应) 氯原子(或—Cl)、羟基(—OH)
取代反应(水解反应) 氯原子(或—Cl)、羟基(—OH) 

 或
或
![]()
【解析】A水解得到乙酸与B,则A属于酯,结合W的结构可知,A为醋酸苯酚酯,即A为![]() ,故W中-R是-CH3,B为
,故W中-R是-CH3,B为![]() 。苯与氢气发生加成反应生成D为
。苯与氢气发生加成反应生成D为![]() ,环己烷与氯气发生取代反应,再在氢氧化钠水溶液、加热条件下发生水解反应生成X,而苯酚与氢气发生加成反应也得到X,故X为
,环己烷与氯气发生取代反应,再在氢氧化钠水溶液、加热条件下发生水解反应生成X,而苯酚与氢气发生加成反应也得到X,故X为![]() ,由(5)中E的分子式是C6H10O可判断X发生催化氧化生成E为
,由(5)中E的分子式是C6H10O可判断X发生催化氧化生成E为![]() ,结合W到A的转化,可知E与过氧化物反应生成酯,故H为
,结合W到A的转化,可知E与过氧化物反应生成酯,故H为![]() ,H发生水解反应得到HOCH2CH2CH2CH2CH2COOH,再在浓硫酸条件下发生缩聚反应生成PCL为
,H发生水解反应得到HOCH2CH2CH2CH2CH2COOH,再在浓硫酸条件下发生缩聚反应生成PCL为![]() 。苯酚与甲醛反应得到Y,Y与溴水反应得到四溴双酚F,Y不含Br原子,Y为2分子苯酚与1分子甲醛脱水得到,Y的苯环上只有2种不同化学环境的氢原子,可知2分子苯酚均以对位与甲醛脱水,故Y为
。苯酚与甲醛反应得到Y,Y与溴水反应得到四溴双酚F,Y不含Br原子,Y为2分子苯酚与1分子甲醛脱水得到,Y的苯环上只有2种不同化学环境的氢原子,可知2分子苯酚均以对位与甲醛脱水,故Y为![]() ,F为
,F为 。
。
(1)由上述分析可知,W中-R是-CH3;(2)由上述分析可知,A的结构简式是![]() ;(3)A生成B和CH3COOH的反应发生酯的水解反应;(4)D→X过程:
;(3)A生成B和CH3COOH的反应发生酯的水解反应;(4)D→X过程:![]() 与氯气发生取代反应生成
与氯气发生取代反应生成![]() ,再在氢氧化钠水溶液、加热条件下发生水解反应生成
,再在氢氧化钠水溶液、加热条件下发生水解反应生成![]() ,引入的官能团分别是氯原子、羟基;(5)由上述分析可知,H的结构简式是
,引入的官能团分别是氯原子、羟基;(5)由上述分析可知,H的结构简式是![]() ;(6)①根据以上分析可知由B生成Y的反应方程式是
;(6)①根据以上分析可知由B生成Y的反应方程式是 ;②由Y生成四溴双酚F的反应方程式是
;②由Y生成四溴双酚F的反应方程式是 ;③在相同条件下,由B转化成四溴双酚F的过程中有副产物生成,该副产物是四溴双酚F的同分异构体,可能是2分子苯酚与甲醛为邻位脱水,或者中为邻位、对位脱水,再与溴水发生取代反应得到,故该副产物的结构简式可能是
;③在相同条件下,由B转化成四溴双酚F的过程中有副产物生成,该副产物是四溴双酚F的同分异构体,可能是2分子苯酚与甲醛为邻位脱水,或者中为邻位、对位脱水,再与溴水发生取代反应得到,故该副产物的结构简式可能是 或
或 ;(7)由上述分析可知,高分子化合物PCL的结构简式是
;(7)由上述分析可知,高分子化合物PCL的结构简式是![]() 。
。

【题目】纳米级Fe3O4呈黑色,因其有磁性且粒度小而在磁记录材料、生物功能材料等诸多领域有重要应用,探究其制备和用途意义重大。
(1)还原-沉淀法:①用还原剂Na2SO3将一定量Fe3+可溶盐溶液中的1/3Fe3+还原,使Fe2+和Fe3+的物质的量比为1:2。②然后在①所得体系中加入氨水,铁元素完全沉淀形成纳米Fe3O4。写出②过程的离子方程式:__________________________。
当还原后溶液中c(Fe2+):c(Fe3+)=2:1时,由下表数据可知,产品磁性最大,可能的原因是___________________________ 。
c(Fe2+):c(Fe3+) | 沉淀性状 | 磁性大小 |
1:3 | 红棕色 | 92.7% |
1:2 | 棕色 | 96.5% |
2:1 | 黑色 | 100% |
(2)电化学法也可制备纳米级Fe3O4,用面积为4cm2的不锈钢小球(不含镍、铬)为工作电极,铂丝作阴极,用Na2SO4溶液作为电解液,电解液的pH维持在10左右,电流50mA。生成Fe3O4的电极反应为________________________。
(3)已知:H2O(l)=H2(g)+1/2O2(g) △H=+285.5kJ·mol-1,以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下,完善以下过程Ⅰ的热化学方程式。
过程Ⅰ:________________________________,
过程Ⅱ:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) △H=+128.9kJ·mol-1

(4)磁铁矿(Fe3O4)常作冶铁的原料,主要反应为:Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
3Fe(s)+4CO2(g),该反应的△H<0,T℃时,在IL恒容密闭容器中,加入Fe3O4、CO各0.5mol,10min后反应达到平衡时,容器中CO2的浓度是0.4mol·L-1。
①T℃时,10min内用Fe3O4表示的平均反应速率为_____g·min-1。
②其他条件不变时,该反应在不同温度下,CO2含量随时间的变化φ(CO2)-t曲线如图所示,温度T1、T2、T3由大到小的关系是_________________,判断依据是___________________。