题目内容
(10分)某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
①分别配置50mL物质的量浓度均为0.100mol/L的CuSO4溶液和NaOH溶液;
②准确量取10mL CuSO4溶液倒入50ml烧杯中
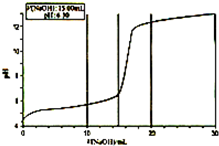
③向烧杯中匀速加入0.100 mol/L的NaOH溶液,并每加入1.00mlNaOH溶液用pH计测一次混合溶液的pH
④当滴入NaOH溶液的体积达到30ml时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时PH变化曲线。如右图
请回答下列问题:
(1)配置溶液时需要使用烧杯、 、 等玻璃仪器;下列仪器中可用于向烧杯中加入NaOH溶液的仪器是 A. 胶头滴管 B.酸式滴定管 C.碱式滴定管 D.量筒
(2)V(NaOH)在2.00ml~15.00ml之间时,溶液中产生绿色沉淀,并不断增加,经检测此沉淀为碱式硫酸铜。当V(NaOH)为15.00ml时,溶液PH为6.32(已知蒸馏水的PH为6.32),则可求得x= y=
(3)V(NaOH)在17.00ml~20.00ml之间时,溶液中出现蓝色沉淀,并不断增加。已知V(NaOH)为20.00ml时,溶液PH为12.25,则此时沉淀中 (填“含”或“不含”)有碱式硫酸铜,请设计实验方案加以证明:
(10分)(1) 玻璃棒、容量瓶、胶头滴管(任选两个,2分) C(2分)
(2)x= 1 (1分) y= 3 (1分)
(3)含有(1分) 检验沉淀中含有硫酸根 或 将沉淀过滤、洗净、干燥后称量与0.001摩尔氢氧化铜的质量比较 (3分)
解析:略

 某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验: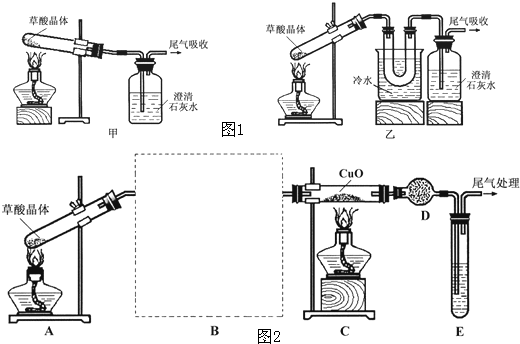

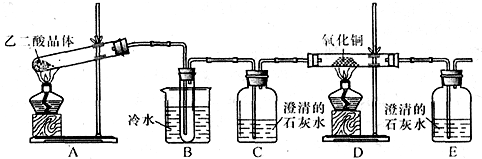
 查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。 进一步探究:
进一步探究: