题目内容
某研究性学习小组通过实验来探究反应生成的淡黄色沉淀的组成和该反应的反应类型,探究过程如下:【实验】向装有某无色溶液的试管中加入足量氢溴酸,产生大量淡黄色沉淀.
【提出假设】
假设1:反应后所得沉淀中只含有
假设2:反应后所得沉淀中只含有
假设3:反应后所得沉淀为二者混合物.
【设计实验方案,验证假设】
(1)甲同学为了验证有无复分解反应的发生,设计的实验方案是:另取少量原无色溶液于试管中,
(2)乙同学受到甲同学的启发,进行了如下实验:另取少量原无色溶液于试管中,滴加足量盐酸,产生淡黄色沉淀.则产生该淡黄色沉淀的离子方程式为
(3)你认为乙同学得到的沉淀中
(4)通过以上实验探究,你认为
分析:淡黄色沉淀可能为S或AgBr,加入氢溴酸出现白色沉淀,若为复分解反应,则沉淀是AgBr,若为氧化还原反应,则沉淀为S.由于SO32-与S2-在酸性条件下反应,则若验证复分解反应不能加酸,若验证氧化还原反应需加酸.加入盐酸后出现淡黄色沉淀,证明假设2正确,但不可能有AgBr沉淀,因SO32-、S2-与Ag+均不能共存,以此来解答.
解答:解:淡黄色沉淀可能为S或AgBr,则假设1为AgBr,假设2为S,
故答案为:AgBr;S;
(1)若为复分解反应,则沉淀是AgBr,实验方案为取少量原无色溶液于试管中,滴加NaBr溶液,若产生淡黄色沉淀,则证明有复分解反应发生;若无现象,则证明无复分解反应发生,故答案为:滴加NaBr溶液,若产生淡黄色沉淀,则证明有复分解反应发生;若无现象,则证明无复分解反应发生;
(2)另取少量原无色溶液于试管中,滴加足量盐酸,产生淡黄色沉淀,发生氧化还原反应,离子反应为SO32-+2S2-+6H+═3S↓+3H2O,
故答案为:SO32-+2S2-+6H+═3S↓+3H2O;
(3)乙同学得到的沉淀中,无另一种沉淀AgBr,因Ag+与SO32-、S2-均发生反应,故答案为:无;因为Ag+与SO32-、S2-均发生反应,故Ag+不存在;
(4)通过以上实验探究可知,假设2正确,故答案为:假设2.
故答案为:AgBr;S;
(1)若为复分解反应,则沉淀是AgBr,实验方案为取少量原无色溶液于试管中,滴加NaBr溶液,若产生淡黄色沉淀,则证明有复分解反应发生;若无现象,则证明无复分解反应发生,故答案为:滴加NaBr溶液,若产生淡黄色沉淀,则证明有复分解反应发生;若无现象,则证明无复分解反应发生;
(2)另取少量原无色溶液于试管中,滴加足量盐酸,产生淡黄色沉淀,发生氧化还原反应,离子反应为SO32-+2S2-+6H+═3S↓+3H2O,
故答案为:SO32-+2S2-+6H+═3S↓+3H2O;
(3)乙同学得到的沉淀中,无另一种沉淀AgBr,因Ag+与SO32-、S2-均发生反应,故答案为:无;因为Ag+与SO32-、S2-均发生反应,故Ag+不存在;
(4)通过以上实验探究可知,假设2正确,故答案为:假设2.
点评:本题考查物质检验、鉴别的实验设计,为高频考点,把握发生氧化还原反应、复分解反应及离子共存为解答的关键,注意反应与结论的关系,题目难度中等.

练习册系列答案
相关题目
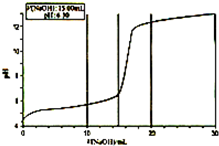 某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验: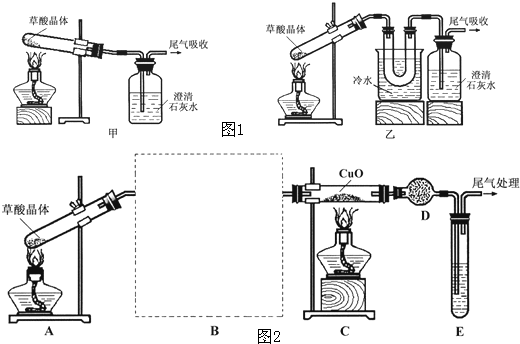

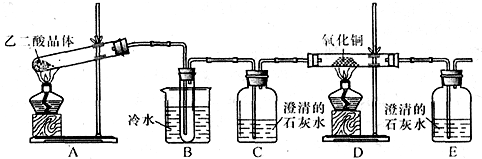
 查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。 进一步探究:
进一步探究: