题目内容
一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的H2在同样条件下完全燃烧生成液态水,放出热量值为Q2,则Q1与Q2的关系为( )
| A.Q1>Q2 | B.Q1=Q2 | C.Q1<Q2 | D.无法确定 |
C
解析

航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑+热量,对此反应下列叙述中错误的是( )。
| A.上述反应属于分解反应 |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.从能量变化来说,主要是化学能转变为动能和热能 |
| D.反应中高氯酸铵只作氧化剂 |
下列反应中,Q2>Q1的是 ( )
| A.H2(g)+F2(g)=2HF(g) ΔH=-Q1 kJ·mol-1 H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) ΔH=-Q1 kJ·mol-1 2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 kJ·mol-1 |
| C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-Q1 kJ·mol-1 NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)ΔH=-Q2 kJ·mol-1 |
| D.S(s)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1 |
石墨和金刚石都是碳的单质,石墨在一定条件下可以转化为金刚石。已知12 g石墨完全转化为金刚石时,要吸收a kJ的能量。下列说法中正确的是( )。
①石墨不如金刚石稳定 ②金刚石不如石墨稳定 ③等质量的石墨和金刚石完全燃烧,金刚石放出的能量多
④等质量的石墨和金刚石完全燃烧,石墨放出的能量多
| A.①② | B.②③ | C.①④ | D.③④ |
已知1g氢气完全燃烧生成水蒸气时放出121kJ的能量,且氧气中1molO=O键完全断裂时需要吸收496kJ的能量,水蒸气中1mol H—O键形成时放出463kJ的能量,则氢气中1mol H—H键断裂时吸收的能量为( )
| A.920kJ | B.557kJ | C.436kJ | D.181kJ |
下列说法或表示方法正确的是( )
| A.反应物的总能量低于生成物的总能量时,一定不能自发进行反应 |
B.已知:CH4(g)+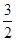 O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热 O2(g)=2H2O(l)+CO(g) ΔH,则ΔH表示CH4的燃烧热 |
| C.恒温恒压时,将2 mol A和1 mol B投入密闭容器中,发生反应:2A(g)+B(g)??2C(g),充分反应后测得放出的热量为Q kJ,则该反应的ΔH=-Q kJ/mol |
| D.由4P(s,红磷)=P4(s,白磷) ΔH=+139.2 kJ/mol,可知红磷比白磷稳定 |
将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见 ( )
| A.NH4HCO3和盐酸的反应是放热反应 |
| B.该反应中,热能转化为产物内部的能量 |
| C.反应物的总能量高于生成物的总能量 |
| D.反应的热化学方程式为NH4HCO3+HCl―→NH4Cl+CO2↑+H2O ΔH=+Q kJ·mol-1 |
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2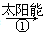 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2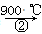 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗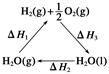 |
| B.该过程实现了太阳能向化学能的转化 |
| C.图中ΔH1=ΔH2+ΔH3 |
| D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O |
已知:①1 mol H2分子中化学键断裂时需要吸收436 kJ的能量 ②1 mol Cl2分子中化学键断裂时需要吸收243 kJ的能量 ③由H原子和Cl原子形成1 mol HCl分子时释放431 kJ的能量。下列叙述正确的是 ( )。
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |